
| A. | 溶液中c(OH-)=$\frac{1000b+c(H+)V}{V}$ mol/L | |
| B. | 溶质的物质的量浓度c=$\frac{1000a}{17V}$ mol/L | |
| C. | 溶质的质量分数w=$\frac{a}{ρV-a}$×100% | |
| D. | 向上述溶液中再加入VmL水后,所得溶液中溶质的质量分数小于0.5w |
分析 A.根据溶液呈电中性,可知n(OH-)=n(H+)+n(NH4+),再根据c=$\frac{n}{V}$计算c(OH-).
B.氨水溶质为氨气,根据n=$\frac{m}{M}$计算氨气的物质的量,再根据c=$\frac{n}{V}$计算溶质的物质的量浓度.
C.根据m=ρV计算溶液质量,再根据质量分数定义计算,注意Vml为溶液体积.
D.溶质质量不变,水的密度比氨水的密度大,比较前后溶液质量变化,根据质量分数定义判断.
解答 解:A.V mL饱和溶液中n(OH-)=n(H+)+n(NH4+)=[c(H+)×10-3+b]mol,所以c(OH-)=$\frac{c({H}^{+})×V×1{0}^{-3}mol+bmol}{V×1{0}^{-3}L}$=$\frac{c({H}^{+})V+1000b}{V}$mol/L,故A正确;
B.氨气的物质的量为$\frac{ag}{17g/mol}$=$\frac{a}{17}$mol,所以溶质的物质的量浓度为$\frac{\frac{a}{17}mol}{V×1{0}^{-3}L}$=$\frac{1000a}{17V}$mol/L,故B正确;
C.溶液质量为Vml×ρg/ml=ρVg,所以溶质的质量分数为$\frac{ag}{ρVg}$×100%=$\frac{100a}{ρV}$%,故C错误;
D.混合前后溶质的质量不变为ag,水的密度比氨水的密度大,即ρg/cm3<ρ水,等体积Vml混合,混合后溶液的质量大于2ρvg,所以混合后质量分数小于小于0.5ω,故D正确;
故选C.
点评 本题考查物质的量浓度、质量分数的有关计算,题目难度中等,注意A中容易认为氢氧根离子与铵根离子的浓度相等,试题培养了学生的分析、理解能力及化学计算能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 21:5 | B. | 2:1 | C. | 4:1 | D. | 11:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 参考如表键能数据和相关物质结构模型,估算热化学方程式:Si(s)+O2(g)═SiO2(s)、P4(s,白磷)+5O2(g)═P4O10(s)中,△H的值分别为( )
参考如表键能数据和相关物质结构模型,估算热化学方程式:Si(s)+O2(g)═SiO2(s)、P4(s,白磷)+5O2(g)═P4O10(s)中,△H的值分别为( )| 化学键 | Si-O | O=O | Si-Si | P-P | P-O | P=O | O=O |
| 键能kJ•mol-1 | 460 | 498.8 | 176 | a | b | c | d |
| A. | -61.2 kJ•mol-1、(4c+12b-4a-5d)kJ•mol-1 | |
| B. | -989.2 kJ•mol-1、(4c+12b-6a-5d)kJ•mol-1 | |
| C. | -989.2 kJ•mol-1、(6a+5d-4c-12b)kJ•mol-1 | |
| D. | -245.2 kJ•mol-1、(4a+5d-4c-12b)kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2+、K+、NO3-、OH- | B. | Ba2+、NH4+、NO3-、OH- | ||
| C. | Ca2+、K+、SO42-、Cl- | D. | Ba2+、Na+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知NaHA溶液呈碱性,则该溶液中:c(A2-)>c(H2A) | |
| B. | 在小苏打溶液中存在下列关系:2c(HCO3-)+2c (CO32-)+2c(H2CO3)=c(Na+) | |
| C. | 常温下,稀释0.1mol/L的氨水,溶液中所有离子浓度均下降 | |
| D. | 向AgCl悬浊液中加入足量的NaI,会观察到有黄色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
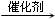
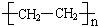 .
.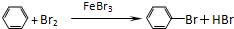 .
.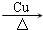 2CH3CHO+2H2O.
2CH3CHO+2H2O. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 直接往该溶液中滴加稀H2S04后产生大量气泡,证明原溶液含C032- | |
| B. | 取少量溶液加入Ba(NO3)2溶液后产生白色沉淀,证明原溶液中含SO42- | |
| C. | 取少量溶液加入HCl酸化后滴加AgN03溶液产生白色沉淀,证明原溶液中含Cl-. | |
| D. | 取少量溶液加入HCl酸化后滴加BaCL2溶液产生白色沉淀,证明原溶液中含SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
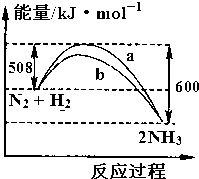
| A. | 该反应的热化学方程式为:N2+3H2?2NH3△H=-92 kJ•mol-1 | |
| B. | 向一密闭容器中加入1 molN2和3 molH2充分反应后,放出92 kJ热量 | |
| C. | b曲线可能是加入催化剂时的能量变化曲线 | |
| D. | 在N2+3H2?2NH3中,反应物的键能之和大于生成物的键能之和 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com