
 “8.12”天津港爆炸中有一定量的氰化物泄露.氰化物多数易溶于水,有剧毒,易造成水污染.为了增加对氰化物的了解,同学们查找资料进行学习和探究.
“8.12”天津港爆炸中有一定量的氰化物泄露.氰化物多数易溶于水,有剧毒,易造成水污染.为了增加对氰化物的了解,同学们查找资料进行学习和探究.| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数( 25℃) | Ka=1.77×10-4 | Ka=5.0×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
分析 探究一:探究氰化物的性质
(1)NaCN为强碱弱酸盐,水解呈碱性;
(2)A、酸的电离常数越大,则酸根离子的水解程度越小;
B、根据强酸制取弱酸判断,反应生成的应该为碳酸氢根离子;
C、图表中电离平衡常数可知HCOOH酸性大于HCN,中和等体积、等pH的HCOOH和HCN溶液HCN溶液浓度大;
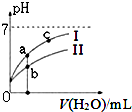
D、先根据电离程度大小判断醋酸、次氯酸对应曲线及起始浓度大小,a、b两点加入水的体积相同,则此时酸溶液浓度取决于酸的起始浓度;
E.$\frac{c({R}^{-})}{c(HR)c(O{H}^{-})}$的分子、分母同时乘以氢离子浓度可得:$\frac{K(HR)}{Kw}$,温度不变,则该比值不变;
(3)H2O2被称为“绿色氧化剂”,其还原产物为水由原子守恒分析A的化学式为KHCO3;
(4)处理含CN-废水时,用NaOH溶液调节至pH=9时(常温),Ki=5.0×10-10,Kh=1.6×109,c(OH-)=10-5,则$\frac{c(HCN)×1{0}^{-5}}{c(C{N}^{-})}$=2×10-5;
探究二:测定含氰水样中处理百分率
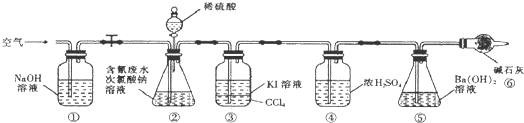
处理含氰废水,并测定含氰废水的处理百分率实验的原理是:利用CN-+ClO-═CNO+Cl-;2CNO-+2H++3ClO-═N2↑+2CO2↑+3Cl-+H2O,通过测定⑤的质量的变化测得二氧化碳的质量,根据关系式计算含氰废水处理百分率.根据装置中试剂的性质推测装置的位置;装置①吸收空气中二氧化碳,排除空气中的二氧化碳对实验的干扰,装置②产生二氧化碳,装置③的作用是吸收装置②中可能产生的Cl2,防止对装置⑤实验数据的测定产生干扰,装置④对产生的二氧化碳进行干燥,根据关系式计算含氰废水处理百分率,装置⑥的作用是排除空气中二氧化碳对实验的干扰,排除空气中二氧化碳对实验的干扰.
(5)实验的原理是利用CN-+ClO-═CNO+Cl-;2CNO-+2H++3ClO-═N2↑+2CO2↑+3Cl-+H2O,通过测定碱石灰的质量的变化测得二氧化碳的质量,根据关系式计算含氰废水处理百分率,实验中应排除空气中二氧化碳的干扰;
(6)通过测定氢氧化钡溶液的质量的变化测得二氧化碳的质量,根据关系式计算含氰废水处理百分率.
解答 解:探究一:探究氰化物的性质
(1)NaCN为强碱弱酸盐,水解呈碱性,反应的离子方程式为:CN-+H2O?HCN+OH-,故答案为:CN-+H2O?HCN+OH-;
(2)A、醋酸的电离常数大于次氯酸,所以醋酸的水解程度小于次氯酸,醋酸钠和次氯酸钠都是强碱弱酸盐,其混合溶液呈碱性,所以相同物质的量浓度的CH3COONa和NaClO的混合液中,各离子浓度的大小关系是:c(Na+)>c(CH3COO-)>c(ClO-)>c(OH-)>c(H+),故A错误;
B、碳酸的二级电离小于次氯酸,所以碳酸氢根离子的酸性小于次氯酸,则向NaClO溶液中通入少量二氧化碳的离子方程式:ClO-+CO2+H2O═HClO+HCO3-,故B错误;
C、图表中电离平衡常数可知HCOOH酸性大于HCN,中和等体积、等pH的HCOOH和HCN溶液HCN溶液浓度大,中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者,故C正确;
D、pH相等的CH3COOH、HClO,稀释相同的倍数时,较强酸中氢离子浓度小于较弱酸,则较弱酸的pH小于较强酸,酸性CH3COOH>HClO,所以a所在曲线表示CH3COOH,b所在曲线表示HClO,次氯酸的电离程度小于醋酸,所以醋酸的浓度减小,次氯酸的浓度较大,a、b两点相比,加入相同体积的水后仍然是次氯酸的浓度较大,即:图象中a点酸的浓度小于b点酸的浓度,故D正确;
E.在$\frac{c({R}^{-})}{c(HR)c(O{H}^{-})}$的分子、分母同时乘以氢离子浓度可得:$\frac{K(HR)}{Kw}$,由于水的离子积和电离平衡常数只受温度影响,a、c的温度相同,则该比值相等,故E正确;
故答案为:CDE;
(3)H2O2被称为“绿色氧化剂”,其还原产物为水,H2O没有污染性,KCN+H2O2+H2O=A+NH3↑,由原子守恒可知A的化学式为KHCO3,
故答案为:KHCO3;
(4)处理含CN-废水时,用NaOH溶液调节至pH=9时(常温),CN-+H2O?HCN+OH-,Ka(HCN)=5.0×10-10,Kh=$\frac{c(O{H}^{-})c(HCN)}{c(C{N}^{-})}$×$\frac{c({H}^{+})}{c({H}^{+})}$=$\frac{Kw}{Ka}$=$\frac{1{0}^{-14}}{5×1{0}^{-10}}$=2×10-5,c(OH-)=10-5,则$\frac{c(HCN)×1{0}^{-5}}{c(C{N}^{-})}$=2×10-5,则c(CN-)<c(HCN);
故答案为:<;
探究二:测定含氰水样中处理百分率
(5)实验的原理是利用CN-+ClO-═CNO+Cl-;2CNO-+2H++3ClO-═N2↑+2CO2↑+3Cl-+H2O,通过测定碱石灰的质量的变化测得二氧化碳的质量,根据关系式计算含氰废水处理百分率,实验中应排除空气中二氧化碳的干扰,防止对装置⑤实验数据的测定产生干扰,装置①和⑥的作用是吸收空气中二氧化碳排除空气中二氧化碳对实验的干扰,
故答案为:吸收空气中二氧化碳排除空气中二氧化碳对实验的干扰;
(6)通过测定氢氧化钡溶液的质量的变化测得二氧化碳的质量,根据关系式计算含氰废水处理百分率,则需要测定装置⑤反应前后的质量,
故答案为:⑤.
点评 本题综合考查物质含量的测定的实验设计、弱电解质的电离,以氯气的性质为载体考查化学实验设计和评价问题,注意把握实验原理和实验方法,(2)注意根据平衡常数确定酸性强弱,从而确定酸之间的转化,结合电荷守恒来分析,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 氯水保存在棕色剂瓶中,碘保存在配有铁盖的试剂瓶中 | |
| B. | 在配制和贮存FeCl3溶液时,要加入少量铁粉,以防在空气中变质 | |
| C. | 烧碱、纯碱等碱性溶液应保存在配有玻璃塞的试剂瓶中 | |
| D. | 漂白粉、烧碱、Na2SiO3均要密封保存 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 草酸晶体的组成可用H2C2O4•xH2O表示,为了测定x值,进行如下实验:称取Wg草酸晶体,配成100mL水溶液.量取25.00mL所配制的草酸溶液置于锥形瓶内,加入适量稀H2SO4后,用浓度为amol•L-1的KMnO4溶液滴定,所发生的反应:KMnO4+H2C2O4+H2SO4=K2SO4+CO2↑+MnSO4+H2O
草酸晶体的组成可用H2C2O4•xH2O表示,为了测定x值,进行如下实验:称取Wg草酸晶体,配成100mL水溶液.量取25.00mL所配制的草酸溶液置于锥形瓶内,加入适量稀H2SO4后,用浓度为amol•L-1的KMnO4溶液滴定,所发生的反应:KMnO4+H2C2O4+H2SO4=K2SO4+CO2↑+MnSO4+H2O查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑤ | B. | ②④⑤ | C. | ④⑤⑧ | D. | 全部正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分类是研究物质性质的一种重要方法 | |
| B. | 许多化学定律的提出是建立在实验事实和逻辑推理基础上的 | |
| C. | 假说最终都可以变成科学理论 | |
| D. | 化学基本原理的应用是有一定条件的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 群众向高处转移 | |
| B. | 用沾NaOH溶液的湿毛巾捂住口鼻 | |
| C. | 用高压水枪向空中喷洒含碱性物质的水溶液可解毒 | |
| D. | 用沾Na2CO3溶液的湿毛巾捂住口鼻 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCN | B. | CH3COOH | C. | HNO2 | D. | HF |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com