
| 选项 | 叙述Ⅰ | 叙述Ⅱ |
A | 晶体硅熔点髙硬度大 | 可用于制作半导体材料 |
| B | 常温下铁与浓硫酸不反应 | 可用铁槽车密封运送浓硫酸 |
| C | NH4HCO3受热易分解 | 可用作氮肥 |
| D | HF与SiO2反应 | 氢氟酸在玻璃器皿上刻蚀标记 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.半导体材料导电性介于导体与绝缘体之间,与熔点和硬度无关;
B.铁与浓硫酸在常温下发生钝化,不是不反应;
C.碳酸氢铵受热易分解为说明碳酸氢铵不稳定,其作氮肥与稳定性无关;
D.氟化氢具有腐蚀性,能够腐蚀玻璃.
解答 解:A.硅单质的导电性介于导体与绝缘体之间,可用于制作半导体材料,与硬度无关,二者没有因果关系,故A错误;
B.常温下用铁槽车密封运送浓硫酸,是因为浓硫酸与铁在常温下发生钝化现象,二者发生了反应,故B错误;
C.NH4HCO3不稳定,加热热易分解,说明碳酸氢铵的稳定性较弱,而碳酸氢铵作氮肥是由于其分子中含有N原子,二者因果关系,故C错误;
D.由于HF与SiO2反应,HF能够腐蚀玻璃,所以可用氢氟酸在玻璃器皿上刻蚀标记,故D正确;
故选D.
点评 本题考查了化学实验方案的评价,题目难度不大,涉及常见元素及其化合物性质、钝化现象等知识,明确常见元素及其化合物性质即可解答,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈紫色 | |
| B. | 在pH=3 的溶液中,Na+、Cl-、Fe2+、ClO-不能大量共存 | |
| C. | 常温下,pH=7的NH4Cl与氨水的混合溶液中:c(Clˉ)=c(NH4+)>c(H+)=c(OHˉ) | |
| D. | 向0.1mol•L-1的氨水中加入少量硫酸铵固体,则溶液中c(OH-)/c(NH3•H2O)减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
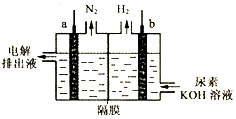
| A. | 电极b与外电源的负极相连 | |
| B. | 电解时,OH-、尿素分子均可穿过隔膜进入左室 | |
| C. | a极反应式为:CO(NH2)2-6e-+H2O═CO2↑+N2↑+6H+ | |
| D. | 每消耗1g尿素则产生标准状况下1.12LH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| W | X | |
| Z |
| A. | 非金属性:W<Z | B. | 简单离子的半径:X2-<Y2+ | ||
| C. | 沸点:H2X<H2Z | D. | WX2的电子式为: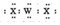 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯碱用于制造玻璃 | B. | 工业上利用合成氨实现人工固氮 | ||
| C. | 打磨磁石制指南针 | D. | 医疗上用小苏打治疗胃酸过多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S$→_{点燃}^{足量O_{2}}$SO3$\stackrel{H_{2}O}{→}$H2SO4 | |
| B. | SiO2$\stackrel{盐酸}{→}$SiCl4$→_{高温}^{H_{2}}$Si | |
| C. | NH3$→_{催化剂、△}^{O_{2}}$NO$\stackrel{O_{2}}{→}$NO2 | |
| D. | Fe$→_{点燃}^{少量Cl_{2}}$FeCl2$\stackrel{NaOH溶液}{→}$Fe(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
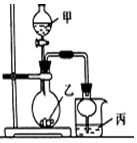 利用图所示装置进行下列实验,其中丙中实验现象描述正确的是( )
利用图所示装置进行下列实验,其中丙中实验现象描述正确的是( )| 实验 | 试剂甲 | 试剂乙 | 试剂丙 | 丙中的现象 |
| A | 70%硫酸 | Na2SO3 | 紫色石蕊试液 | 溶液先变红后褪色 |
| B | 浓盐酸 | KMnO4 | 含酚酞的NaOH溶液 | 溶液褪色 |
| C | 稀盐酸 | CaCO3 | BaCl2溶液 | 有白色沉淀生成 |
| D | 浓氨水 | CaO | AlCl3溶液 | 先生成白色沉淀然后沉淀溶解 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
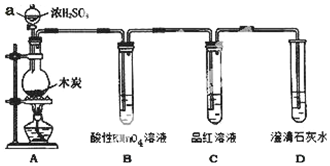 为了探究木炭与浓H2SO4反应的产物中是否存在CO2,某同学选用如图所示装置进行实验:
为了探究木炭与浓H2SO4反应的产物中是否存在CO2,某同学选用如图所示装置进行实验: .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com