
【题目】氰[(CN)2]的化学性质与卤素(X2)很相似,化学上称之为拟卤素,其氧化性介于Br2和I2之间,下列有关反应方程式不正确的是
A. (CN)2和NaOH溶液反应:(CN)2+2OH-=CN-+CNO-+H2O
B. MnO2和HCN反应:MnO2+4HCN(浓)![]() Mn(CN)2+(CN)2↑+2H2O
Mn(CN)2+(CN)2↑+2H2O
C. 在NaBr和KCN混合溶液中通入少量Cl2:Cl2+2CN-=2Cl-+(CN)2
D. 向KCN溶液中加入碘水:I2+2KCN=2KI+(CN)2
【答案】D
【解析】
氰[(CN)2]的化学性质与卤素(X2)很相似,其氧化性介于Br2和I2之间,则其氧化性强、弱顺序为:Cl2>Br2>(CN)2>I2,所以还原性强、弱顺序为:I->CN->Br->Cl-,结合氯气的性质分析解答。
A.根据Cl2和氢氧化钠的反应Cl2+2NaOH=NaCl+NaClO+H2O类推,(CN)2和NaOH溶液反应:(CN)2+2OH-=CN-+CNO-+H2O,A正确;
B.根据二氧化锰和浓盐酸反应的方程式类推可知MnO2和HCN反应:MnO2+4HCN(浓)![]() Mn(CN)2+(CN)2↑+2H2O,B正确;
Mn(CN)2+(CN)2↑+2H2O,B正确;
C.在氧化还原反应中,当有多种还原剂时,往往是还原剂最强的优先反应,所以在NaBr和KCN混合溶液中通入少量Cl2,首先氧化CN-:Cl2+2CN-=2Cl-+(CN)2,C正确;
D.若该反应能够发生,则说明I2的氧化性大于(CN)2,显然与题给的氧化性强、弱的信息不符,故该反应不能发生,D错误;
答案选D。


科目:高中化学 来源: 题型:
【题目】常温下,将![]() 和
和![]() 两种酸溶液分别加水稀释至体积为
两种酸溶液分别加水稀释至体积为![]() ,稀释液
,稀释液![]() 与其体积变化的关系如图所示。下列说法正确的是 ( )
与其体积变化的关系如图所示。下列说法正确的是 ( )

A.![]() 和
和![]() 均为一元弱酸
均为一元弱酸
B.常温下,浓度均为![]() 的
的![]() 和
和![]() 溶液,溶液
溶液,溶液![]()
C.![]() 、
、![]() 两点对应溶液中一定存在:
两点对应溶液中一定存在:![]()
D.分别往![]() 、
、![]() 两点对应溶液中滴加
两点对应溶液中滴加![]() 溶液至恰好完全反应,消耗
溶液至恰好完全反应,消耗![]() 溶液的体积相等
溶液的体积相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现行教材中给我们介绍的“铝热反应”是用铝粉和氧化铁混合物,在镁条燃烧产生的高温下发生反应的。
(1)该反应的化学方程式为:__________________________________________________;
该反应是________(填“吸热”或“放热”)反应;以上叙述中除镁条外,还缺少一种药品,它是__________,在该反应中的作用是____________________________________________。
(2)工业冶金常用以下四法:①焦炭法;②水煤气法;③活泼金属置换法;④电解法。
用“铝热反应”原理冶炼金属锰属于_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁晶体(FeSO47H2O)是医药上补血剂的有效成分。某课外小组测定该补血剂中铁元素含量的流程如下(已知其它成分在测定过程中不参与反应),回答下列问题:
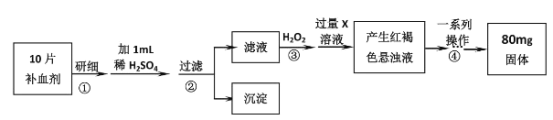
(1)步骤①研细的目的是_______。
(2)证明步骤②滤液中含有Fe2+的方法是_______。
(3)步骤③加入H2O2的目的_______,发生反应的离子方程式是_______。
(4)步骤③后过量X溶液是_______(填化学式)溶液。
(5)步骤④中一系列操作依次是_______、洗涤、灼烧、冷却、称量。
(6)假设实验无损耗,正常人每天应补充16.8mg左右的铁,如果全部通过服用上述测定的补血剂片来补充,则正常人每天需服用上述补血剂_______片。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有氯化钠和碘化钠的混合物共26.7 g,溶于水,通入足量氯气后,蒸干、灼烧,固体质量变为 17.55 g。
(1)原混合物中碘化钠的质量是________。
(2)原混合物中氯化钠的质量分数是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子、元素、核素、同位素等都属于重要的化学基本概念。下列八种化学符号:![]() H、
H、![]() H、
H、![]() C、
C、![]() Li、
Li、![]() Na、
Na、![]() N、
N、![]() Li、
Li、![]() Mg
Mg
(1)涉及的核素共有__种;
(2)互为同位素的是__、__;
(3)质量数相等,但不能互称为同位素的是__;
(4)中子数相等,但质子数不相等的是__。
(5)氢的三种同位素是__,它们与氯的同位素35Cl、37Cl相互结合为氯化氢,可得氯化氢分子的种数为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾 (K2FeO4)是一种新型,高效的绿色水处理剂。工业上利用硫酸亚铁为原料,通过铁黄 (FeOOH)制备高铁酸钾,可降低生产成本产品质量优工艺流程如下:

化学兴趣小组的同学们在实验室中,通过KClO溶液与Fe(NO3)3溶液的反应模拟工业生产制备高铁酸钾,下图所示是模拟工业制备KClO溶液装置。

已知:K2FeO4可溶于水、微溶于浓KOH溶液;在强碱性溶液中比较稳定;在Fe3+催化作用下发生分解。
(1)工业流程中,需要加入试剂A制备铁黄(FeOOH),最合适的试剂A是:________。
A.Cl2 B.O2 C.KMnO4 D.HNO3
流程中制备铁黄涉及到的离子反应方程式:_______。
实验测得反应溶液的pH对铁黄产率的影响如下图所示,pH大于4.5时铁黄产率逐降低的主要原因可能是:______。

(2)根据工业流程推断,溶解度K2FeO4________ Na2FeO4 (填“>”或“<”)
(3)实验室使用KClO溶液和饱和Fe(NO3)3液制备高铁酸钾时,两种试剂的滴加顺序为________。
(4) K2FeO4在水溶液中易水解,在“提纯”K2FeO4中采用重结晶洗涤、低温烘干的方法,则洗涤剂最好选用____溶液(填序号)
a.水 b.NH4Cl、异丙醇 c. Fe(NO3)3、异丙醇 d.异丙醇
(5)工业上用“间接碘量法”测定高铁酸钾的纯度:用碱性KI溶液溶解1.00g K2FeO4样品,调节pH使高铁酸根全部被还原成亚铁离子,再调节pH为3~4,用1.00mol/l的Na2S2O3标准溶液作为滴定剂进行滴定(2Na2S2O3+I2= Na2S4O6+2NaI),淀粉作指示剂,三次滴定,消耗Na2S2O3标准溶液分别17.98、18.02、18.95mL。原样品中高铁酸钾的质量分数为________。[M(K2FeO4)=198g/mol]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是
A.常温常压下,14 g N2含有分子数为NA
B.过氧化钠与水反应,生成0.1 mol氧气时,转移的电子数为0.2NA
C.物质的量浓度为0.5 mol/L的MgCl2溶液,含有Cl-数目为1NA
D.一定条件下,0.01 mol FeCl3与水完全反应制成胶体,其含有的Fe(OH)3胶粒数为0.01 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、氮、硫及其化合物对生产、生活有重要的意义。
(1)以![]() 与
与![]() 为原料可合成尿素。已知:
为原料可合成尿素。已知:
①![]()
![]()
②![]()
![]()
③![]()
![]()
写出NH3和CO2合成尿素和液态水的热化学方程式________。
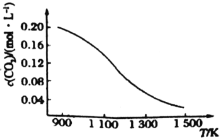
(2)高温下,CO2与足量的碳在密闭容器中实现反应:![]() 。向容积为1L的恒容容器中加入0.2molCO2,在不同温度下达到平衡时CO2的物质的量浓度随温度的变化如图所示。则该反应为________(填“放热”或“吸热”)反应;某温度下若向该平衡体系中再通入0.2molCO2,达到新平衡后,体系中CO的百分含量________(填“变大”、“变小”或“不变”)。
。向容积为1L的恒容容器中加入0.2molCO2,在不同温度下达到平衡时CO2的物质的量浓度随温度的变化如图所示。则该反应为________(填“放热”或“吸热”)反应;某温度下若向该平衡体系中再通入0.2molCO2,达到新平衡后,体系中CO的百分含量________(填“变大”、“变小”或“不变”)。
(3)一定量的![]() 与足量的碳在体积可变的恒压密闭容器中反应:
与足量的碳在体积可变的恒压密闭容器中反应:![]() ,平衡时体系中气体体积分数与温度的关系如图所示:
,平衡时体系中气体体积分数与温度的关系如图所示:
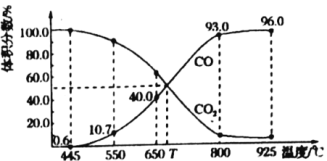
①650℃时,反应达平衡后![]() 的转化率为________。
的转化率为________。
②![]() ℃时,平衡常数
℃时,平衡常数![]() ________
________![]() (用平衡分压代替平衡浓度计算,分压
(用平衡分压代替平衡浓度计算,分压![]() 总压
总压![]() 体积分数)。
体积分数)。
(4)![]() 与
与![]() 能发生反应:
能发生反应:![]()
![]() 在固定体积的密闭容器中,使用某种催化剂,改变原料气配比进行多次实验(各次实验的温度可能相同,也可能不同),测定
在固定体积的密闭容器中,使用某种催化剂,改变原料气配比进行多次实验(各次实验的温度可能相同,也可能不同),测定![]() 的平衡转化率。部分实验结果如图所示:
的平衡转化率。部分实验结果如图所示:
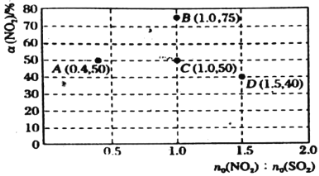
①当容器内________(填标号)不再随时间的变化而改变时,反应达到平衡状态。
A.气体的压强 B.气体的平均摩尔质量 C.气体的密度 D.![]() 的体积分数
的体积分数
②如果要将图中C点的平衡状态改变为B点的平衡状态,应采取的措施是________。
③若A点对应实验中,![]() 的起始浓度为
的起始浓度为![]() ,经过
,经过![]() 达到平衡状态,该时段化学反应速率
达到平衡状态,该时段化学反应速率![]() ________
________![]() 。
。
④图中C、D两点对应的温度分别为![]() ℃和
℃和![]() ℃,通过计算判断
℃,通过计算判断![]() ________
________![]() (填“
(填“![]() ”、“
”、“![]() ”或“
”或“![]() ”)。
”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com