
分析 配合物也叫络合物,由中心原子、配位体和外界组成,中心原子或离子(统称中心原子)和围绕它的称为配位体(简称配体)的分子或离子,完全或部分由配位键结合形成,配合物中中心原子提供空轨道,配体提供孤电子对;命名配离子时,配位体的名称放在前,中心原子名称放在后,配位体和中心原子的名称之间用“合”字相连,中心原子为离子者,在金属离子的名称之后附加带圆括号的罗马数字,以表示离子的价态.
解答 解:(1)[Co(NH3)5Cl](NO3)2中,Co3+为中心离子,电荷数为+3,Cl、NH3为配体,有一个氯离子和五个氨分子做配体,配位数为6,名称为:硝酸一氯•五氨合钴(III),
故答案为:Co3+;NH3、Cl;6;硝酸一氯•五氨合钴(III);
(2)[Co(en)3]3+中,Co3+为中心离子,电荷数为+3,乙二胺为配体,有三个乙二胺做配体,配位数为6,名称为:三(乙二胺)合钴(III)离子,
故答案为:Co3+;en;6;三(乙二胺)合钴(III)离子;
(3)[Cu(NH3)4]2+中,Cu2+为中心离子,电荷数为+2,Cl、NH3为配体,有四个氨分子做配体,配位数为4,名称为:四氨合铜(Ⅱ)离子,
故答案为:Cu2+;NH3;4;四氨合铜(Ⅱ)离子;
(4)[FeF6]3-中,Fe3+为中心离子,电荷数为+3,F为配体,有六个F做配体,配位数为6,名称为:六氟合铁(Ⅲ)离子,
故答案为:Fe3+;F;6;六氟合铁(Ⅲ)离子;
(5)[Cd(NH3)4]2+中,Cd2+为中心离子,电荷数为+2,NH3为配体,有四个氨分子做配体,配位数为4,名称为:四氨合镉(Ⅱ)离子,
故答案为:Cd2+;NH3;4;四氨合镉(Ⅱ)离子;
(6)[Zn(NH3)4]SO4中,Zn2+为中心离子,电荷数为+2,NH3为配体,有四个氨分子做配体,配位数为4,名称为:硫酸四氨合锌(Ⅱ)离子,
故答案为:Zn2+;NH3;4;硫酸四氨合锌(Ⅱ)离子;
(7)K2[HgI4]中,Hg2+为中心离子,电荷数为+2,I为配体,有四个碘原子做配体,配位数为4,名称为:四碘合汞(II)酸银,
故答案为:Hg2+;I;4;四碘合汞(II)酸银;
(8)[Co(NH3)5H2O]Cl3中,Co2+为中心离子,电荷数为+2,NH3、H2O为配体,有一个氯离子和五个氨分子做配体,配位数为6,名称为:三氯化一水五氨合钴,
故答案为:Co2+;NH3、H2O;6;三氯化一水五氨合钴;
(9)H2[PtCl6]中,Pt4+为中心离子,电荷数为+4,Cl为配体,有六个氯离子做配体,配位数为6,名称为:六氯合铂(Ⅳ)酸,
故答案为:Pt4+;Cl;6;六氯合铂(Ⅳ)酸;
(10)[PtCl2(NH3)2]中Pt2+为中心离子,电荷数为+2,Cl、NH3为配体,有二个氯离子和二个氨分子做配体,配位数为4,名称为:二氯二氨合铂(II),
故答案为:Pt2+;Cl、NH3;4;二氯二氨合铂(II);
(11)NH4[SbCl6]中,Sb4+为中心离子,电荷数为+4,Cl为配体,有六个氯离子做配体,配位数为6,名称为:六氯合锑(Ⅵ)酸铵,
故答案为:Sb4+;Cl;6;六氯合锑(Ⅵ)酸铵;
(12)Fe3[Fe(CN)6]2中,Fe2+为中心离子,电荷数为+2,CN为配体,有六个CN-做配体,配位数为6,名称为:六氰合铁(Ⅱ)酸铁(Ⅲ),
故答案为:Fe2+;CN-;6;六氰合铁(Ⅱ)酸铁(Ⅲ).
点评 本题考查配合物的成键情况、配合物的命名,注意配体、中心离子、外界离子以及配位数的判断,把握相关概念,特别注意配体和外界离子的区别,题目难度中等.


 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 二氧化硅溶于水显酸性 | |
| B. | 二氧化碳通入水玻璃(Na2SiO3的水溶液)可以得到白色胶状物质 | |
| C. | 因为高温时,二氧化硅与碳酸钠反应放出二氧化碳,所以硅酸的酸性比碳酸强 | |
| D. | 二氧化硅是酸性氧化物,它不溶于任何酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
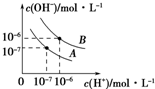 已知水在25℃和95℃时,其电离平衡曲线如图所示.
已知水在25℃和95℃时,其电离平衡曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2mol A+1mol B | |
| B. | 1mol C+1mol D | |
| C. | 2mol C+2mol D | |
| D. | 0.5mol A+0.5mol B+0.5mol C+1mol D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当x=2时,每生成lmolN2,转移电子数为4mol | |
| B. | 该反应中化合价变化的有N和C元素 | |
| C. | 等物质的量N2和C02中,共用电子对的个数比为3:4 | |
| D. | 氧化剂与还原剂的物质的量之比为1:1时,NOx中氮元素的化合价为+2价 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaO+H2O═Ca(OH)2 | B. | 2NH4HCO3$\stackrel{△}{→}$2NH3↑+H2O+CO2↑ | ||
| C. | 4HCl+O2$\stackrel{△}{→}$2H2O+2Cl2 | D. | NaHCO3+NaHSO4═Na2SO4+CO2↑+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com