
【题目】溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种。①加入铝片,产生无色无味的气体;②加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法正确的是( )
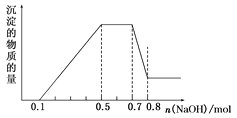
A.溶液中一定不含CO32-,可能含有SO42-和NO3-
B.在滴加NaOH溶液物质的量为0.5~0.7mol时,发生离子反应为Al3++4OH-=AlO2-+2H2O
C.溶液中的阳离子只有H+、Mg2+、Al3+
D.n(H+)∶n(NH4+)∶n(Mg2+)=2∶4∶1
【答案】D
【解析】
根据题意知,①溶液中加入铝片,产生无色无味的气体为氢气,则溶液中有大量氢离子,则没有碳酸根和硝酸根离子,根据电中性原则知,溶液中一定含有硫酸根;②加入NaOH溶液,产生白色沉淀,说明溶液中一定不含铁离子;当溶液中含氢离子、铵根离子、镁离子、铝离子时,加入氢氧化钠,先与氢离子反应,再与镁、铝离子反应生成氢氧化物沉淀,再与铵根离子反应得到一水合氨,再与氢氧化铝反应生成偏铝酸钠。
A、溶液中加入铝片,产生无色无味的气体为氢气,则溶液中有大量氢离子,则一定不含CO32-和NO3-,根据电中性原则知,一定含有SO42-,故A错误;
B、根据题给图像知,在滴加NaOH溶液物质的量为0.5至0.7mol时,发生的离子反应为:NH4++OH-=NH3·H2O,故B错误;
C、根据题给图像知,溶液中的阳离子一定含NH4+、H+、Mg2+、Al3+,故C错误;
D、根据题给图像分析,氢离子消耗氢氧根离子的物质的量是0.1mol,所以氢离子的物质的量是0.1mol,氢氧化钠为0.5至0.7mol时,发生的离子反应为:NH4++OH-=NH3·H2O,所以铵离子的物质的量为0.2mol ,氢氧化钠为0.7至0.8mol时,发生反应Al(OH)3+OH-=AlO2-+2H2O,所以Al3+的物质的量是0.1mol,镁离子的物质的量是(0.4mol-0.1mol ×3)÷2=0.05mol,n(H+)∶n(NH4+)∶n(Mg2+) =2∶4∶1,故D正确。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】铜铁及其化合物在日常生活和工业生产中有着重要用途。
(1)铁制炊具在潮湿的空气中易发生吸氧腐蚀而生锈,负极的电极反应式为:___,正极的电极反应式为:___。
(2)下列哪些装置可防止铁棒被腐蚀___。(填正确答案标号)
A.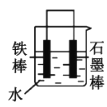 B.
B.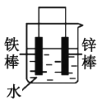 C.
C.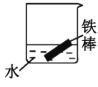 D.
D.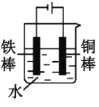
(3)高铁酸钾(K2FeO4)广泛应用于净水、电池工业等领域。工业上以钛白粉生产的副产品FeSO4制备高铁酸钾的生产流程如图:
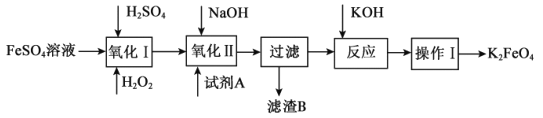
查阅资料:K2FeO4在水中溶解度很大,在碱性环境中稳定,在中性和酸性条件下不稳定。
①“氧化I”中,生成Fe3+的离子反应方程式是___。
②净水时高铁酸钾能逐渐与水反应生成絮状的Fe(OH)3,请补充并配平该反应方程式: K2FeO4+ H2O= Fe(OH)3↓+ KOH+ 。___。
(4)工业上常以铜做阳极,石墨做阴极,电解含有NaOH的NaCl水溶液制备Cu2O。
已知:该电解过程中阳极先生成难溶物CuCl,再与NaOH反应转化为Cu2O。
①写出阳极的电极反应式___,该过程中生成Cu2O的离子反应方程式为___。
②如果电解后溶液体积未发生变化,电解后溶液中的c(OH-)会___(填“变大”“变小”或“不变”)。
③若电解时电路中通过0.2mol电子,理论上生成Cu2O的质量为___g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4A(s)+3B(g)![]() 2C(g)+ D(g),经2minB的浓度减少0.6mol/L。对此反应速率的表示正确的是
2C(g)+ D(g),经2minB的浓度减少0.6mol/L。对此反应速率的表示正确的是
A. 用A表示的反应速率是0.4 mol/(L·min)
B. 分别用B、C、D表示的反应速率其比值是3:2:1
C. 在2min末的反应速率,用B表示是0.3mol/(L·min)
D. 在这2min内用B和C表示的反应速率的值都是逐渐减小的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
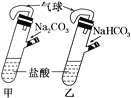
A.分别在甲乙两支侧管中装入1.06gNa2CO3和0.84gNaHCO3,试管中各有10mL相同浓度的盐酸(如图)同时将两个侧管中的物质全部倒入各自的试管中,乙装置的气球膨胀速率大
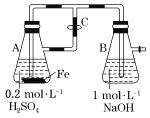
B.用如图装置可以制备沉淀Fe(OH)2
C.取少量Fe(NO3)2试样加水溶解,加稀H2SO4酸化,滴加KSCN溶液,溶液变为红色。结论:该Fe(NO3)2试样已经变质
D.Al(OH)3中混有少量Mg(OH)2:加入足量烧碱溶液充分反应,过滤,向滤液中通入过量CO2后过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:Zn(s) +![]() O2(g) =ZnO(s) ΔH1=-351.1kJ/mol
O2(g) =ZnO(s) ΔH1=-351.1kJ/mol
Hg(l) +![]() O2(g) = HgO(s) ΔH2=-90.7kJ/mol
O2(g) = HgO(s) ΔH2=-90.7kJ/mol
由此可知Zn(s) + HgO(s) = ZnO(s) + Hg(l)的ΔH3,其中ΔH3的值是
A.-260.4 kJ/molB.-254.6 kJ/molC.-438.9 kJ/molD.-441.8 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把 NaOH、MgCl2、AlCl3 三种固体组成的混合物溶于足量水后,产生 1.16g 白色沉淀, 再向所得浊液中逐渐加入 2.00mol/LHCl 溶液,加入HCl 溶液的体积与生成沉淀的关系如图所示。
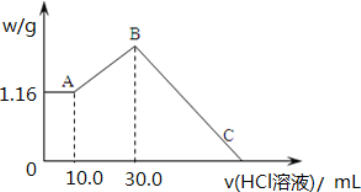
(1)A 点沉淀物的化学式为_____。B 点纵坐标为___________________。
(2)A 点至B 点改为通入二氧化碳气体,至少须标准状况下二氧化碳_____mL。此时发生反应的离子方程式为_____。
(3)B 点含溶质的物质的量是_____mol。C 点(此时沉淀恰好完全溶解)HCl 溶液的体积为_____mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的密闭容器中,X、 Y、Z三种气体的物质的量随时间变化的曲线如图所示:

下列描述正确的是( )
A. 反应开始到10s,用Z表示的反应速率为0.158mol/(L·s)-1
B. 反应开始到l0s,X的物质的量浓度减少了0.79mol/L
C. 反应开始到10s时,Y的转化率为79.0%
D. 反应的化学方程式为:X(g)+Y(g)![]() Z(g)
Z(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生利用如图装置对电解质溶液导电性进行实验探究。下列说法中正确的是( )

A. 闭合开关K,电流计指针发生偏转,证明HCl溶液是电解质
B. 闭合开关K,向烧杯中加入NaCl固体,由于HCl与NaCl不反应,故电流计指针不发生变化
C. 闭合开关K,向溶液中加入CaCO3固体,电流计示数不变
D. 选取相同浓度的硫酸替换0.1 mol·L-1的HCl溶液,电流计的示数相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】露置于空气中的某氢氧化钠固体样品溶于水,向所得溶液中逐滴加入稀盐酸至过量,生成的CO2(标准状况)与加入的盐酸体积的关系如图所示(不考虑CO2在水中的溶解)。
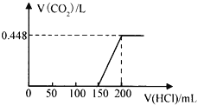
(1)写出 0~150mL 段发生反应的离子方程式为:____________;150mL ~200mL段发生反应的离子方程式为:___________________;
(2)所用盐酸的物质的量浓度为_______________;
(3)将上述氢氧化钠固体样品溶于水,所形成溶液的溶质为___________、_________(写化学式),其物质的量分别为 ____________、_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com