

分析 (1)N2H4结合H2O电离的氢离子使溶液呈碱性;
(2)①平衡常数只受温度影响,据此判断;
②增大压强平衡向气体体积减小的方向移动;
③在C点时,二氧化碳与二氧化氮的浓度相等,根据反应2NO2(g)+2C(s)?N2(g)+2CO2(g),可知氮气的浓度为二氧化碳的一半,据此确定各成份气体的体积分数,进而确定反应的压强平衡常数Kp;
(3)①弱酸电离常数越大,酸性越强,其酸根离子水解程度越小;
②亚硝酸的电离程度大于一水合氨的电离程度,铵根离子的水解程度大于亚硝酸根离子的程度;
(4)利用盖斯定律将②×4-①可得CaO(s)+3CO(g)+SO2(g)?CaS(s)+3CO2(g)反应热;
(5)①pH=13时,c(S2-)=5.7×10-2mol/L,在0.10mol•L-1H2S溶液中根据硫守恒c(H2S)+c(HS-)+c(S2-)=0.10mol•L-1;
②当Qc=Ksp(MnS)时开始沉淀,由此求出硫离子的浓度,结合图象得出此时的pH;
解答 解:(1)肼易溶于水,它是与氨类似的弱碱,则电离生成OH-和阳离子,电离方程式为N2H4•H20?N2H5++OH-,
故答案为:N2H4•H20?N2H5++OH-;
(2)①平衡常数只受温度影响,所以Kc(A)=Kc(B) ,
故答案为:Kc(A)=Kc(B);
②增大压强平衡向气体体积减小的方向移动,该反应的正反应是气体体积增大的反应,所以A、B、C三点中NO2的转化率最高的是A点,
故答案为:A;
③在C点时,二氧化碳与二氧化氮的浓度相等,根据反应2NO2(g)+2C(s)?N2(g)+2CO2(g),可知氮气的浓度为二氧化碳的一半,所以混合气体中CO2的体积分数为$\frac{2}{5}$,NO2的体积分数$\frac{2}{5}$,N2的体积分数$\frac{1}{5}$,所以反应的压强平衡常数Kp=$\frac{{p}^{2}(CO{\;}_{2})p({N}_{2})}{{p}^{2}(N{O}_{2})}$=$\frac{(10×\frac{2}{5})^{2}×10×\frac{1}{5}}{({10×\frac{2}{5})}^{2}}$MPa=2MPa,
故答案为:2 MPa;
(3)①由亚硝酸的电离平衡常数Ki=5.1×10 -4,H2CO₃的Ki1=4.2×10-7,Ki2=5.61×10-11,可判断水解程度大小顺序为CO32->NO2-,水解生成HCO3-,所以溶液中CO32-离子、HCO3-离子和NO2-离子的浓度大小关系为[HCO3-]>[NO2-]>[CO32-],
故答案为:[HCO3-]>[NO2-]>[CO32-];
②已知在25℃时,一水合氨的Ki=1.8×10-5,亚硝酸的电离平衡常数Ki=5.1×10 -4,所以亚硝酸的电离程度大于一水合氨的电离程度,则铵根离子的水解程度大于亚硝酸根离子的程度,根据越弱越水解,铵根离子的水解程度大,所以最后所得溶液为酸性,
故答案为:酸性;
(4)利用盖斯定律将②×4-①可得CaO(s)+3CO(g)+SO2(g)?CaS(s)+3CO2(g)△H=4×(-47.3kJ•mol-1)-(210.5kJ•mol-1)=-399.7kJ•mol-1,
故答案为:-399.7;
(5)①根据溶液pH与c(S2-)关系图pH=13时,c(S2-)=5.7×10-2mol/L,在0.10mol•L-1H2S溶液中根据硫守恒c(H2S)+c(HS-)+c(S2-)=0.10mol•L-1,所以c(H2S)+c(HS-)=0.1-5.7×10-2=0.043mol/L,
故答案为:0.043;
②当Qc=Ksp(FeS)时开始沉淀,所以c(S2-)=$\frac{Ksp(FeS)}{c(Fe{\;}^{2+})}$=$\frac{1.4×10{\;}^{-19}}{0.01}$mol/L=1.4×10-17mol/L,结合图象得出此时的pH=2,所以pH=2时亚铁离子开始沉淀,
故答案为:2.
点评 本题考查物质弱电解质的电离、化学平衡、盐类的水解、沉淀的溶解平衡等,掌握平衡移动原理是解题的关键,是对知识的综合考查,需要学生具有扎实的基础与分析问题、解决问题的能力.


科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18O2-结构示意图: | |
| B. | 硝基苯的结构简式: | |
| C. | NaHSO4熔融时电离方程式:NaHSO4═Na++HSO4- | |
| D. | 模型 可表示甲烷分子或四氯化碳分子 可表示甲烷分子或四氯化碳分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. (任意填一种).
(任意填一种).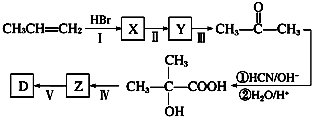
查看答案和解析>>
科目:高中化学 来源: 题型:实验题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0LpH=12的CH3COONa溶液中OH-一定为0.01NA | |
| B. | 常温下,20g2H2O含有的电子数为10NA | |
| C. | mgNa2O2与水反应产生1molO2时转移电子数为2NA | |
| D. | 标准状况下,22.4LN2和CO的混合物中含用电子对数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 :下列对这种元素的分析中正确的( )
:下列对这种元素的分析中正确的( )| A. | 最外层电子数为3 | |
| B. | 最高价氧化物对应水化物的分子式可能是H3RO4 | |
| C. | 最高价为+3价 | |
| D. | 此元素可能是24号元素铬(Cr)或25号元素锰(Mn) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质谱法是快速、微量、精确测定相对分子质量的方法 | |
| B. | 红外光谱仪不可用于测定化合物的官能团 | |
| C. | 用核磁共振氢谱鉴别1-溴丙烷和2-溴丙烷 | |
| D. | 氯溴碘代甲烷存在同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 往装有铁钉的试管中加入2 mL水、3滴稀醋酸和1滴K3[Fe(CN)6]溶液,可以观察到铁钉表面粘附气泡,同时周围出现蓝色沉淀 | |
| B. | 在测定大理石与盐酸反应速率的实验中,用排水法测量一定时间内收集气体的体积 | |
| C. | 皂化反应后的混合液,需加入热饱和NaHCO3溶液,会有高级脂肪酸钠析出,然后再分液得到肥皂 | |
| D. | 在简易量热计测定反应热时,取用浓度均为0.5mol•L-1稀盐酸和氢氧化钠溶液各50mL、缓慢混合并搅拌使酸和碱充分反应、准确读取实验时温度计最高温度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com