
【题目】下列现象或事实可用同一原理解释的是
A.新制的氨水、氯水放置时间较久而变质
B.![]() 能使溴水和品红溶液褪色
能使溴水和品红溶液褪色
C.![]() 和
和![]() 溶液使酸性高锰酸钾溶液的紫色褪去
溶液使酸性高锰酸钾溶液的紫色褪去
D.浓硫酸和浓盐酸长期暴露在空气中浓度降低
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】根据电化学知识回答下列问题。
Ⅰ、某小组同学设想用如图装置电解硫酸钾溶液来制取氧气、氢气、硫酸和氢氧化钾。
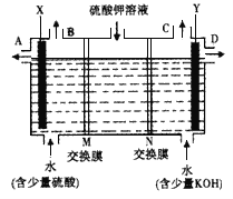
(1)X极与电源的_____(填正或负)极相连,氢气从____ (选填A、 B、C或D)口导出。
(2)离子交换膜只允许一类离子通过,则M为________(填阴离子或阳离子,下同)交换膜,N为________交换膜。
(3)若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池(石墨为电极),则电池正极的电极反应式为___________________
Ⅱ、铅蓄电池是常见的二次电池,其放电反应和充电反应表示如下:Pb(s)+PbO2(s)+2H2SO4(aq)![]() 2PbSO4(s)+2H2O(l)
2PbSO4(s)+2H2O(l)
写出它放电时正极的电极反应式______________________________________;
充电时阴极的电极反应式______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,10mL 0.40mol/L H2O2 溶液发生催化分解。不同时刻测得生成![]() 的体积(已折算为标准状况)如下表。
的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)
A. 0~6min的平均反应速率:v(H2O2)=3.3×10-2mol/(L·min)
B. 6~10min的平均反应速率:v(H2O2)<3.3×10-2mol/(L·min)
C. 反应到6min时,c(H2O2)=0.30mol/L
D. 反应到6min时,H2O2 分解了50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述不正确的是
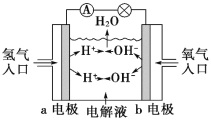
A. a电极是负极
B. b电极的电极反应为:4OH--4e-=2H2O+O2↑
C. 氢氧燃料电池是一种具有应用前景的绿色电源
D. 氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z组成的化合物Y2X和ZX2。Y2X溶于水形成的溶液能与ZX2反应生成一种化合物Y2ZX3。已知三种元素原子的质子总数为25,且Z和Y的原子序数之和比X的原子序数2倍还多1,Z原子有2个电子层,最外层电子数是核外电子数的2/3倍,试回答:
(1)X元素的名称:X____,Y元素在元素周期表中的位置____,Z元素的原子结构示意图_______。
(2)用电子式表示ZX2的形成过程_____。
(3)Y2X对应水化物的电子式_____,其中存在的化学键有_____。
(4)写出Y2X溶于水的溶液与ZX2反应的化学方程式_______。
(5)X的氢化物比同主族的氢化物的熔沸点明显偏高的原因____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图(左)是还原铁粉与水蒸气反应的实验装置,实验时,B中灰色的铁粉变为黑色,且生成的黑色固体物质是一种可溶于稀盐酸的较复杂化合物。请回答下列问题:
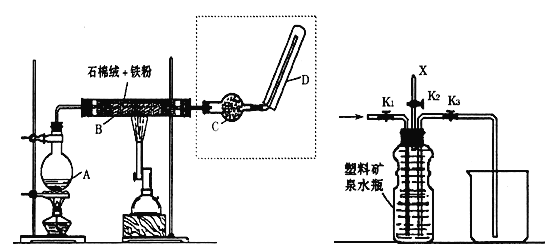
(1)B中发生反应的化学方程式为___________________
(2)反应前后A中投放碎瓷片的目的是________________________。
(3)某次实验后,取B中的固体物质少量,溶于足量稀盐酸,再滴加KSCN溶液。溶液颜色无明显变化,试解释原因__________________。
(4)上图(左)中虚线部分,可以用右图所示装置代替,在X口点燃收集到的气体即可检验H2的存在。实验开始时,打开K1、K2,关闭K3,使反应先进行一段时间之后,必须要进行______________操作,方可关闭K2、打开K3,再收集气体。当收集到半瓶气体时,停止加热,关闭K1,若要使H2顺利逸出而进行点燃实验,操作的方法是____________________。
(5)替代装置未像原装置那样使用干燥管,同样顺利完成了实验,原因是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下进行甲、乙、丙三组实验:三组各取30.0 mL同浓度的盐酸溶液,加入同一种镁铝合金粉末,产生气体,有关数据列表如下:
实验序号 | 甲 | 乙 | 丙 |
合金质量/mg | 255 | 385 | 459 |
产生气体体积/mL | 280 | 336 | 336 |
请回答:
(1)甲组实验中,盐酸______________(选填“适量”“过量”或“不足量”,下同),理由是______________。要算出盐酸的物质的量浓度,题中可作计算依据的数据是______________。求得的盐酸的物质的量浓度为______________。
(2)求合金中Mg、Al的物质的量之比,题中可作计算依据的数据是______________,求得的Mg、Al的物质的量之比为______________;
(3)在丙组实验之后,向容器中加入1.00 mol·L-1 NaOH溶液,能使合金中的铝恰好溶解,不形成铝的沉淀,并使Mg2+刚好沉淀完全,再过滤出不溶性固体,求滤液中各溶质的物质的量和所加入NaOH溶液的体积(写计算过程)。___________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液可能含有Na+、NH4+、Mg2+、Al3+、SO42-、NO3-、Cl-中的几种,为确定其成分,完成了如下实验(已知:3NO3-+8Al+5OH-+2H2O ![]() 3NH3↑+ 8AlO2- )
3NH3↑+ 8AlO2- )

根据实验现象,所得结论错误的是
A.沉淀1加酸部分溶解,则含Mg2+和SO42-B.可能含Na+、Cl-
C.沉淀2加酸溶解,则含Al3+D.气体1遇水显碱性,则含NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】仅用下表提供的玻璃仪器(非玻璃仪器任选)或实验装置就能实现相应实验目的的是( )
选项 | A | B | C | D |
实验目的 | 除去KCl中少量的MnO2 | 用10mol·L-1的盐酸配制100mL0.1 mol·L-1的盐酸 | 用氯化钠溶液制备氯化钠晶体 | 除去CO2气体中的HCl |
实验仪器或装置 | 烧杯、玻璃棒、分液漏斗 | 100mL容量瓶、玻璃棒、烧杯 |
|
|
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com