
某工厂废水中含5.00×10-3 mol·L-1的Cr2O72-,其毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁性材料Cr0.5 Fe1.5FeO4的流程图示意如下:
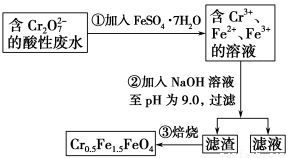
下列有关判断错误的是( )。
A.操作①中反应的离子方程式为Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
B.操作②所得的滤渣成分主要为Fe(OH)3、Fe(OH)2、Cr(OH)3
C.磁性材料Cr0.5Fe1.5FeO4中,显+3价铁与显+2价铁的质量之比为2∶3
D.若废水中杂质不与绿矾反应,将该1 L废水中的Cr2O72-完全转化为Cr0.5Fe1.5FeO4,理论上需加入绿矾13.9 g
C
【解析】①步骤,在酸性溶液中Cr2O72-与Fe2+反应生成Cr3+、Fe3+、H2O,离子方程式为Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,A选项正确;向含Fe2+、Fe3+、Cr3+的溶液中加入氢氧化钠溶液后,得到三种沉淀:Fe(OH)2、Fe(OH)3、Cr(OH)3,B选项正确;这三种氢氧化物焙烧失水得到磁性材料Cr0.5Fe1.5FeO4,元素化合价没有变化,该化学式中Cr显+3价,若+2价铁为1.5 mol,+3价铁为1 mol,则正化合价代数和为3×0.5+2×1.5+3×1=7.5,负化合价代数和为(-2)×4=-8,化学式中总的化合价代数和不等于0,由此说明,+2价铁为1 mol,+3价铁为1.5 mol,故说明该材料中,n(Fe2+)∶n(Fe3+)=1 mol∶1.5 mol=2∶3,C选项不正确;D选项,理论上,1 L废液中含有Cr2O72-:n(Cr2O72-)=5.00×10-3 mol·L-1×1 L=5.00×10-3 mol,根据关系式:Cr2O72-~4Cr0.5Fe1.5FeO4~10FeSO4·7H2O得出,理论上需要绿矾:m(FeSO4·7H2O)=5.00×10-3 mol×10×278 g·mol-1=13.9 g,D选项正确。


科目:高中化学 来源:2014年高二化学苏教版选修2 2专题综合检测练习卷(解析版) 题型:选择题
下列有关铁、铝的冶炼的说法中,正确的是( )。
A.冶金工业中,金属铁的冶炼主要采用电解法
B.炼铁过程中铁的氧化物被焦炭还原生成单质铁,电解冶炼铝的过程中,阳极生成铝单质,阴极生成氧气
C.炼铁的主要原料是铁矿石、焦炭、生石灰和空气,电解冶炼铝的原料是氧化铝和冰晶石
D.铁、铝冶炼设备分别是炼铁高炉和铝电解槽
查看答案和解析>>
科目:高中化学 来源:2014年高二化学苏教版选修2 1专题综合检测练习卷(解析版) 题型:填空题
在一条鱼虾几乎绝迹的小河边从上游到下游依次有四座工厂,甲、乙、丙、丁四厂排放的废液中含有Na2CO3、FeCl3、Ca(OH)2、HCl中的一种;某中学环保小组对河水检测时发现:甲处河水呈乳白色,乙处河水呈红褐色,丙处河水变浑浊,丁处产生气泡,河水仍然澄清。试回答:
(1)四处河水排放的污染物分别是:甲________,乙________,丙________,丁________。
(2)在丁处的下游取出的河水中,肯定含有的离子是_____________________________。
(3)小河中鱼虾绝迹的原因是_______________________________________________。
查看答案和解析>>
科目:高中化学 来源:2014年高二化学苏教版选修2 1.3海水淡化练习卷(解析版) 题型:选择题
某工厂对江水进行净化沉淀、杀菌消毒、降低水的硬度,以获得所需工业用水,则依次选用的试剂和方法是( )。
A.Na3PO4、Cl2、离子交换法
B.石灰、纯碱、漂白粉
C.明矾、离子交换法、漂白粉
D.明矾、漂白粉、离子交换法
查看答案和解析>>
科目:高中化学 来源:2014年高二化学苏教版选修2 1.2硬水软化练习卷(解析版) 题型:选择题
不能使永久硬水发生软化的方法是( )。
A.煮沸法 B.纯碱法
C.Na3PO4 D.离子交换法
查看答案和解析>>
科目:高中化学 来源:2014年高二化学人教版选修四 9化学平衡常数练习卷(解析版) 题型:填空题
在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K= 。
(2)该反应为 反应(填“吸热”或“放热”)。
(3)能判断该反应是否达到化学平衡状态的依据是( )
A.容器中压强不变
B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O)
D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 ℃。
查看答案和解析>>
科目:高中化学 来源:2014年高二化学人教版选修四 8化学平衡移动练习卷(解析版) 题型:选择题
反应2X(g)+Y(g) 2Z(g)+Q,在不同温度(T1和T2)及压强(p1和p2)下,产物Z的物质的量n与反应时间t的关系如下图所示。下列判断正确的是( )
2Z(g)+Q,在不同温度(T1和T2)及压强(p1和p2)下,产物Z的物质的量n与反应时间t的关系如下图所示。下列判断正确的是( )

A.T1<T2,p1<p2B.T1<T2,p1>p2
C.T1>T2,p1>p2D.T1>T2,p1<p2
查看答案和解析>>
科目:高中化学 来源:2014年高二化学人教版选修四 7化学平衡状态的建立及标志练习卷(解析版) 题型:选择题
在一定温度下,将等物质的量的CO和水蒸气通入恒容密闭容器中,发生如下反应:
CO(g)+H2O(g) CO2(g)+H2(g),一段时间后反应达到平衡。对该平衡状态描述正确的是( )
CO2(g)+H2(g),一段时间后反应达到平衡。对该平衡状态描述正确的是( )
A.正反应速率等于零
B.正反应速率大于逆反应速率
C.正反应速率等于逆反应速率
D.正反应速率小于逆反应速率
查看答案和解析>>
科目:高中化学 来源:2014年高二化学人教版选修四 3燃烧热 能源练习卷(解析版) 题型:选择题
甲烷是一种高效清洁的新能源,0.25 mol CH4完全燃烧生成液态水时放出222.5 kJ热量,则下列热化学方程式中正确的是( )
A.2CH4(g)+4O2(g) 2CO2(g)+4H2O(l) ΔH=+890 kJ·mol-1
2CO2(g)+4H2O(l) ΔH=+890 kJ·mol-1
B.CH4(g)+2O2(g) CO2(g)+2H2O(l) ΔH=+890 kJ·mol-1
CO2(g)+2H2O(l) ΔH=+890 kJ·mol-1
C.CH4(g)+2O2(g) CO2(g)+2H2O(l) ΔH=-890 kJ·mol-1
CO2(g)+2H2O(l) ΔH=-890 kJ·mol-1
D.2CH4(g)+4O2(g) 2CO2(g)+4H2O(l) ΔH=-890 kJ·mol-1
2CO2(g)+4H2O(l) ΔH=-890 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com