
 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源:不详 题型:单选题
| A.在共价化合物中可能含有离子键,离子化合物中也可能存在共价键 |
| B.稀有气体分子是由稀有气体的原子组成的,故其中必含有共价键 |
| C.阳离子一定是金属离子, 阴离子一定只含有非金属元素 |
| D.在过渡元素中可以寻找制备催化剂及耐高温和耐腐蚀合金材料的元素 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | | | | | | | |
| 2 | | | | D | E | | G | I |
| 3 | B | | C | | F | | H | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.Z="a+b+c" |
| B.若c<b,该微粒一定是原子 |
| C.c≤b=8 |
| D.若c=b,该微粒可能是原子或阴离子 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.原子半径大小顺序是c>b>d>a |
| B.d的氢化物比a的氢化物稳定 |
| C.a和d的原子结合可以形成带3个负电荷的阴离子 |
| D.a、b、c最高价氧化物对应水化物的酸性强弱关系是c>b>a |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
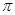 键之比是 。
键之比是 。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com