
| A. | SiO2与CO2相似,由一个硅原子和两个氧原子构成一个SiO2分子 | |
| B. | 硅酸盐一般不溶于水,它是水泥、陶瓷、玻璃的主要成分 | |
| C. | SiO2是酸性氧化物,能和碱反应,不能和酸反应 | |
| D. | 硅元素是构成矿物岩石的主要成分之一,其化合态几乎全部是氧化物和硅酸盐 |
分析 A、二氧化硅不是分子;
B、水泥、玻璃、陶瓷等硅酸盐材料,硅酸钠盐溶于水;
C、二氧化硅能与氢氟酸反应;
D、硅石及硅酸盐中含有大量硅元素.
解答 解:A、二氧化硅不是分子,硅和氧的原子个数比为1:2,故A错误;
B、水泥、玻璃、陶瓷等硅酸盐材料,硅酸钠盐溶于水,所以硅酸盐一般不溶于水,它是水泥、陶瓷、玻璃的主要成分,故B正确;
C、二氧化硅能与氢氟酸反应,所以不是不能和酸反应,故C错误;
D、硅是亲氧元素,在自然界中以化合态存在,是组成硅石和硅酸盐的主要元素,故D正确;
故选BD.
点评 本题考查了硅的性质,知道自然界中硅、Al都属于亲氧元素,导致这两种元素在自然界中不能以游离态存在,知道硅只和酸中的HF反应,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3溶液与醋酸:CO32-+2CH3COOH═2CH3COO-+H2O+CO2↑ | |
| B. | 碳酸氢铵溶液与足量NaOH溶液:HCO3-+OH-═H2O+CO32- | |
| C. | 用醋酸除水垢:2CH3COOH+CaCO3═Ca2++2CH3COO-+H2O+CO2↑ | |
| D. | 向NaHSO4溶液中逐滴加入Ba(OH)2溶液至呈中性:H++SO42-+Ba2++OH-═H2O+BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Li2NH中N的化合价是-1 | B. | 该反应中H2既是氧化剂又是还原剂 | ||
| C. | H-的离子半径比Li+大 | D. | 此法储氢和钢瓶储氢的原理相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢钠与醋酸反应:HCO3-+H+═CO2↑+H2O | |
| B. | 等物质的量的硫酸氢钠与氢氧化钡溶液:SO42-+H++Ba2++OH-═H2O+BaSO4↓ | |
| C. | 氯化铝溶液中加入过量氨水:Al3++3OH-═Al(OH)3↓ | |
| D. | 金属钠与H2O 反应:Na+H2O═Na++OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
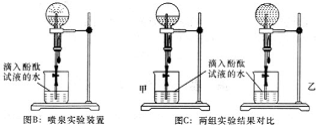
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5项 | B. | 4项 | C. | 3项 | D. | 2项 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
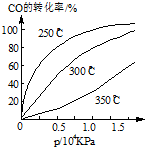 研究NO2、SO2.CO等大气污染气体的处理具有重要意义.
研究NO2、SO2.CO等大气污染气体的处理具有重要意义.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com