
下列反应的离子方程式书写正确的是( )
A.Fe(NO3)3溶液中加入足量HI溶液:2Fe3++2I-=2Fe2++I2
B.用H2O2和H2SO4的混合溶液蚀刻铜:Cu+H2O2+2H+=Cu2++2H2O
C.NH4HCO3溶液中加入足量澄清石灰水:Ca2++HCO3-+OH-=CaCO3↓+H2O
D.C12通入NaOH溶液:Cl2+OH-=Cl-+ClO-+H2O
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2016-2017学年安徽省高二上期中文化学卷(解析版) 题型:选择题
离子化合物是离子通过离子键结合成的化合物.下列物质属于离子化合物的是()
A H2O B HCl C NaCl D.CO2
查看答案和解析>>
科目:高中化学 来源:2017届安徽省高三上学期期中化学试卷(解析版) 题型:选择题
已知在碱性溶液中可发生如下反应:Fe(OH)3+ClO-+OH-→FeO4n-+Cl-+ H2O(未配平)。则有关叙述不正确的是
H2O(未配平)。则有关叙述不正确的是
A.已知FeO4n-中Fe的化合价是+6价,则n=2
B.每产生1molCl-,转移2mol电子
C.FeO4n-具有强氧化性,一般其还原产物为Fe3+,可用作新型自来水消毒剂和净水剂
D.若n=2,该反应中氧化剂与还原剂的物质的量之比为2:3
查看答案和解析>>
科目:高中化学 来源:2017届山东省高三上第一次质检化学试卷(解析版) 题型:实验题
硫的化合物在工业上有广泛的应用,因此研究硫的化合物制备有着重要的意义.某同学拟采用下图装置(实验前已除尽装置内的空气)来制取焦亚硫酸钠(Na2S2O5).已知装置图l—II中有Na2S2O5晶体析出,发生的反应为Na2SO3+SO2=Na2S2O5
(l)装置I是用亚硫酸钠固体和浓硫酸制备二氧化硫气体,该装置中反应的化学方程式为______________;如果想控制反应速度,图2中可选用的发生装置是_______(填写字母).
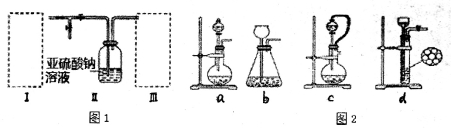
(2)装置Ⅱ中有Na2S2O5晶体析出,要获得已析出的晶体可采取的分离方法是________________
(3)装置III用于处理尾气,可选用的最佳试剂是______________(填序号).
a、饱和食 盐水 b、NaOH溶液 c、浓硫酸 d、饱和NaHCO3溶液
盐水 b、NaOH溶液 c、浓硫酸 d、饱和NaHCO3溶液
(4)Na2S2O5与稀硫酸反应放出SO2,其离子方程式为___________________
(5)工业制备得到产品Na2S2O5中含有杂质碳酸钠,检验产品中含有碳酸钠杂质所需试剂是___________(填编号)(已知Na2S2O5溶于水即生成NaHSO3)
①酸性高锰酸钾 ②品红溶液 ③澄清石灰水
④饱和碳酸氢钠溶液 ⑤NaOH ⑥稀硫酸
查看答案和解析>>
科目:高中化学 来源:2017届山东省高三上第一次质检化学试卷(解析版) 题型:选择题
向CuSO4溶液中逐滴加入KI溶液至过量,观察到产生白色沉淀CuI,溶液变为棕色。再向反应后的混合物中不断通入SO2气体,溶液逐渐变成无色。下列分析正确的是( )
A.滴加KI溶液时,转移2 mol e-时生成1 mol白色沉淀
B.通入SO2时,SO2与I2反应,I2作还原剂
C.通入SO2后溶液逐渐变成无色,体现了SO2的漂白性
D.上述实验条件下,物质的氧化性:Cu2+>I2>SO2
查看答案和解析>>
科目:高中化学 来源:2017届山东省高三上第一次质检化学试卷(解析版) 题型:选择题
信息、材料、能源被称为新科技革命的“三大支柱”,下列观点或做法错误的是:( )
A.在即将到来的新能源时代,太阳能、氢能等将成为主要能源
B.新能源汽车的推广与使用有助于减少光化学烟雾的产生
C.光缆在信息产业中有广泛应用,制造光缆的主要材料是晶体硅
D.高温结构陶瓷氮化硅(Si3N4)具有较高 的硬度和耐磨性,可用于制造汽车发动机
的硬度和耐磨性,可用于制造汽车发动机
查看答案和解析>>
科目:高中化学 来源:2017届内蒙古高三上第二次月考化学试卷(解析版) 题型:选择题
在恒容密闭容器中通入X并发生反应:2X(g) 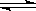 Y(g),在温度T1、T2下,Y的物质的量浓度c(Y)随时间t变化的曲线如图所示,下列叙述正确的是
Y(g),在温度T1、T2下,Y的物质的量浓度c(Y)随时间t变化的曲线如图所示,下列叙述正确的是

A.该反应进行到M点放出的热量大于进行到W点放出的热量
B.N点的逆反应速率v逆大于W点的逆反应速率v逆
C.T1 > T2
D.M点时再加入一定量X,平衡后X的转化率减小
查看答案和解析>>
科目:高中化学 来源:2017届湖北省高三上第四次质检化学试卷(解析版) 题型:填空题
CO和联氨(N2H4)的性质及应用的研究是能源开发、环境保护的重要课题。
(1)①用CO、O2和KOH溶液可以制成碱性燃料电池,则该电池反应的离子方程式为 。
②用CO、O2和固体电解质还可以制成如下图1所示的燃料电池,则电极d的电极反应式为 。
(2)联氨的性质类似于氨气,将联氨通入CuO浊液中,有关物质的转化如图2所示。
①在图示2的转化中,化合价不变的元素是 (填元素名称)。
②在转化过程中通入氧气发生反应后,溶液的pH将 (填“增大” 、“减小”或“不变”)。转化中当有1 mol N2H4参与反应时,需要消耗O2的物质的量为 。
、“减小”或“不变”)。转化中当有1 mol N2H4参与反应时,需要消耗O2的物质的量为 。
③加入NaClO时发生的反应为:Cu(NH3) +2ClO-+2OH-=Cu(OH)2↓+2N2H4↑+2Cl-+2H2O
+2ClO-+2OH-=Cu(OH)2↓+2N2H4↑+2Cl-+2H2O
该反应需在80℃以上进行,其目的除了加快反应速率外,还有 、 。

图3
(3)CO与SO2在铝矾土作催化剂、773 K条件下 反应生成CO2和硫蒸气,该反应可用于从烟道气中回收硫,反应体系中各组分的物质的量与反应时间的关系如图3所示,写出该反应的化学方程式: 。
反应生成CO2和硫蒸气,该反应可用于从烟道气中回收硫,反应体系中各组分的物质的量与反应时间的关系如图3所示,写出该反应的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上期中化学卷(解析版) 题型:选择题
已知:可逆反应N2(g)+3H2(g)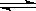 2NH3(g)△H<0。现有甲、乙两个容积相同且不变的真空密闭容器,向甲容器中加入1molN2(g)和3molH2(g),在一定条件下发生反应,达到平衡时放出热量为Q1kJ。在相同条件下,向乙容器中加入2molNH3(g)并发生反应,达到平衡时吸收热量为Q2kJ,若Q1=3Q2。下列叙述中正确的是
2NH3(g)△H<0。现有甲、乙两个容积相同且不变的真空密闭容器,向甲容器中加入1molN2(g)和3molH2(g),在一定条件下发生反应,达到平衡时放出热量为Q1kJ。在相同条件下,向乙容器中加入2molNH3(g)并发生反应,达到平衡时吸收热量为Q2kJ,若Q1=3Q2。下列叙述中正确的是
A.达平衡时甲中NH3的体积分数为75%
B.达平衡时甲、乙中NH3的体积分数乙>甲
C.达到平衡后,再向乙中加入0.25molN2(g)、0.75molH2(g)和1.5molNH3(g),平衡向生成NH3的方向移动
D.乙中反应的热化学方程式为2NH3(g)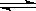 N2(g)+3H2(g);△H=+Q2kJ/mol
N2(g)+3H2(g);△H=+Q2kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com