
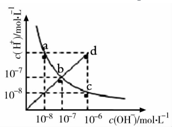
| A. | ac曲线上的任意一点都有c(H+)×c(OH-)=10-14 | |
| B. | CH3COONa溶液不可能位于c点 | |
| C. | d点对应溶液的温度高于25°C,PH<7 | |
| D. | bd线段上任意一点对应的溶液都呈中性 |
分析 A.a、c两点温度相同,水的离子积不变,根据b点氢离子、氢氧根离子浓度可知水的离子积为c(H+)•c(OH-)=10-14;
B.c点氢氧根离子浓度大于氢离子浓度,溶液为碱性,醋酸钠为碱性溶液;
C.水的电离为吸热反应,温度越高,水的电离程度越大;
D.b、d线段上的任意一点都满足c(H+)=c(OH-),溶液显示中性.
解答 解:A.a c曲线上的任意一点,由于温度相同,所以水的离子积相同,根据b点可知,c(H+)•c(OH-)=10-14,故A正确;
B.在c点c(H+)=1×10-8mol/L,c(OH-)=1×10-6mol/L,溶液显示碱性,而醋酸钠溶液显示碱性,所以c点可能为醋酸钠溶液,故B错误;
C.d点时,c(H+)=c(OH-)=1×10-6mol/L>1×10-7mol/L,溶液的pH=6,水的电离为吸热反应,所以d点温度高于25℃,故C正确;
D.b、d线上任意点都满足c(H+)=c(OH-),溶液一定显示中性,故D正确;
故选B.
点评 本题考查了水的电离及影响因素,题目难度不大,注意明确影响水的电离的因素,明确溶液酸碱性取决于溶液中氢离子与氢氧根离子的浓度大小,不能以溶液的pH判断溶液酸碱性.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | $\frac{m}{32}$mol | B. | $\frac{m}{64}$mol | C. | $\frac{n}{11.2}$mol | D. | $\frac{n}{22.4}$mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
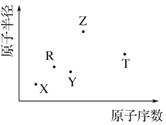 短周期主族元素 X、Y、Z、R、T 的原子半径与原子序数关系如图 所示.R 原子最外层电子数是电子层数的 2 倍,Y 与 Z 能形成 Z2Y、Z2Y2型离子化合物,Z 与 T 形成的化合物 Z2T 能破坏水的电离平衡.下列推断正确的是( )
短周期主族元素 X、Y、Z、R、T 的原子半径与原子序数关系如图 所示.R 原子最外层电子数是电子层数的 2 倍,Y 与 Z 能形成 Z2Y、Z2Y2型离子化合物,Z 与 T 形成的化合物 Z2T 能破坏水的电离平衡.下列推断正确的是( )| A. | 原子半径和离子半径均满足:Y<Z | |
| B. | 最高价氧化物对应水化物的酸性:T<R | |
| C. | 氢化物的沸点不一定是:Y>R | |
| D. | 由 X、R、Y、Z 四种元素组成的化合物水溶液一定显碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KClO3是氧化剂 | B. | P2O5是氧化产物 | ||
| C. | 1molKClO3参加反应有6mole-转移 | D. | 每有6molP被还原,生成5molKCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO3-,K+,[Al(OH)4]-,OH- | B. | Na+,Ba2+,Mg2+,HCO3- | ||
| C. | NO3-,Mg2+,K+,Cl- | D. | NH4+,NO3-,CO32-,Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{1}^{2}$H | B. | ${\;}_{1}^{3}$H | C. | ${\;}_{2}^{4}$He | D. | ${\;}_{1}^{1}$H |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cd(OH)2 | Mn(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.2 | 8.2 |
| 沉淀完全的pH | 3.3 | 9.9 | 9.5 | 10.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业电解精炼铜时,粗铜与外电源的正极相连 | |
| B. | 常温下向纯水中加入盐酸,水的离子积减小 | |
| C. | 催化剂既能改变化学反应速率,也能改变焓变 | |
| D. | 其它条件不变时,升髙温度,吸热反应的v(正)增大,v(逆)减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com