
| A.3.36L | B.2.8L | C.6.72L | D.4.48L |
 作业辅导系列答案
作业辅导系列答案科目:高中化学 来源:不详 题型:填空题
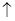 。
。
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 组 | A | B | C | D |
| 甲槽 | NaOH | Cu(N O3)2 | KCl | Na2SO4 |
| 乙槽 | CuSO4 | NaCl | AgNO3 | NaNO3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①③ | B.①②③ | C.①②③④ | D.①②④⑤ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
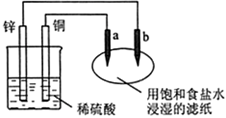
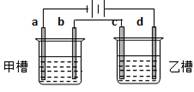
| A.a是正极,发生还原反应,b是阴极,发生还原反应 |
| B.装置工作时,稀硫酸溶液中C(H+)变小、C(Cu2+)变大 |
| C.往滤纸上滴加酚酞试液,a极附近颜色变红 |
| D.稀硫酸中硫酸根离子的物质的量不变 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
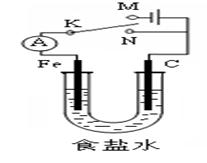
| A.若电键K与N连接,铁被保护不会腐蚀 |
| B.若电键K与N连接,正极反应式是4OH- -4e-=2H2O+O2↑ |
| C.若电键K与M连接,将石墨棒换成铜棒,铁棒上立即有铜生成 |
| D.若电键K与M连接,当两极共产生22.4 L(标准状况)气体时,生成了1 molNaOH |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
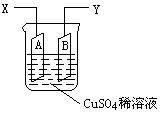
 6min后,假设溶液体积不变,测得溶液中CuSO4物质的量浓度为0.1mol/L,则原溶液中CuSO4物质的量浓度 mol/L。溶液中H+的物质
6min后,假设溶液体积不变,测得溶液中CuSO4物质的量浓度为0.1mol/L,则原溶液中CuSO4物质的量浓度 mol/L。溶液中H+的物质 mol/L。
mol/L。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.电解过程中有0.02mol电子转移 |
| B.阳极产物只有氯气 |
| C.在标准状况下,阳极产生的气体体积为0.448L |
| D.电解后溶液的pH =12 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com