
| A. | F | B. | Cl | C. | Al | D. | I |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | X的最高正价比Y的小 | |
| B. | X的最高价氧化物一定是X2O,Y的气态氢化物为H2Y | |
| C. | X的离子半径比Y的大 | |
| D. | X的核电荷数比Y的小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氯化铜、氯化亚铜是重要的化工原料,广泛用作有机合成催化剂.
氯化铜、氯化亚铜是重要的化工原料,广泛用作有机合成催化剂.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②③④ | C. | ②④ | D. | 全部正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2(g)+Cl2(g)=2HCl(g)△H=-184.6kJ/mol | |
| B. | CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-802.3kJ/mol | |
| C. | 2C8H18(g)+25O2(g)=16CO2(g)+18H2O(l)△H=-5518kJ/mol | |
| D. | CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ③④ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
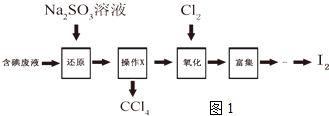
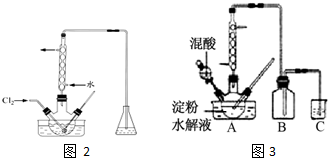
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com