
在氮的单质和常见化合物中(用N2、NH3、NH4Cl填空)
(1)常用作保护气(如填充灯泡、焊接保护等)的物质是 ,
(2)常用作制冷剂的物质是 ,
(3)能与酸反应生成盐,在常温下为气态的物质是 ,
(4)用作氮肥的是 。
科目:高中化学 来源:2010-2011学年吉林省高考复习质量监测(理综)化学部分 题型:填空题
(15分)
M、N、R、T为周期表中前四周期相邻两个周期的元素,且原子序数依次增大。已知T的次外层上电子没有排满,且该能层中成对电子数等于其它各能层上电子的总数;R和T在同一族;N的外围电子总数为6,均为未成对电子。根据以上信息,回答下列问题:
(1)T的元素符号为 ,在周期表中位于 族,N的价电子排布式为 。
(2)M和R两种元素组成的常见化合物有两种,其中一种可以单质之间进行化合,生成R的高价态化合物,请写出该反应的化学方程式: 。
(3)表面上附着氮原子的R可做为工业催化剂,下图为氮原子在R的晶面上的单层附着局部示意图(图中小黑色球代表氮原子, 灰色球代表R原子)。则图示颗粒表面上氮原子与R原子的个数比为 。

(4)T、N都有多种配合物,[T(NH3)3(H2O)M2]M是T配合物的一种,其中心离子的化合价为 ,配位数为 。N与甲基丙烯酸根的配合物为:
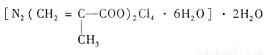 该化合物中存在的化学键类型有
。甲基丙烯酸分子中C原子的杂化方式有
。
该化合物中存在的化学键类型有
。甲基丙烯酸分子中C原子的杂化方式有
。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
非金属知识规律总结
【高考导航】
一、非金属元素在周期表中的位置和结构特点
1、除H外,非金属元素均在“阶梯线”的右上方。共有16种非金属元素,其中包括稀有气体元素6种。
2、非金属元素(包括稀有元素)均在主族(零族)。非金属元素一般都有变价。
3、最外层电子数一般≥4(H、B除外)。
4、原子半径比同周期金属半径小(稀有元素除外)。
二、非金属性强弱的判断依据
元素非金属性的本质是元素的原子吸引电子的能力。试题常通过以下几个方面来比较元素的非金属性:
1、单质跟H2化合难易程度(反应条件,剧烈程度,反应热的大小,生成气态氢化物的稳定性)。
2、最高价氧化物对应水化物的酸性。
3、化合物中元素化合价的正负,如BrCl中,Cl为-1价,Br为+1价,说明非金属性Cl>Br。
4、通过氧化还原反应确定非金属单质的氧化能力,进而比较非金属性。
需要指出的是,非金属单质的活动性与非金属元素的活动性,有密切的联系,但不是一回事。例如氮元素的非金属性相当强,可是它的单质N2化学性质却不很活泼。单质的化学性质不仅取决于原子结构,而且取决于分子结构和晶体结构。
三、非金属元素的性质及递变规律
1、单质:
(1)结构:除稀有气体外,非金属原子间以共价键结合。非金属单质的成键有明显的规律性。若它处在第N族,每个原子可提供8-N个价电子去和8-N个同种原子形成8-N个共价单键,可简称8-N规则;(H遵循2-N规则)。如ⅦA族单质:x-x;H的共价数为1,H-H,第ⅥA族的S、Se、Te共价单键数为8-6=2,第ⅤA族的P、As共价单键数8-5=3。但第二周期的非金属单质中N2、O2形成多键。
(2)熔沸点与聚集态。它们可以分为三类:
①小分子物质。如:H2、O2、N2、Cl2等,通常为气体,固体为分子晶体。
②多原子分子物质。如P4、S8、As4等,通常为液态或固态。均为分子晶体,但熔、沸点因范德华力较大而比①高,Br2、I2也属此类,一般易挥发或升华。
③原子晶体类单质。如金刚石、晶体硅和硼等,是非金属单质中高熔点“三角区”,通常为难挥发的固体。
(3)导电性:非金属一般属于非导体,金属是良导体,而锗、硅、砷、硒等属于半导体。但半导体与导体不同之处是导电率随温度升高而增大。
(4)化学活性及反应:
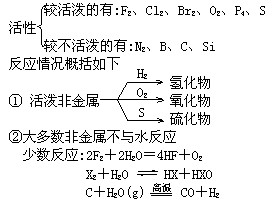
③非金属一般为成酸元素,难以与稀酸反应。 固体非金属能被氧化性酸氧化。
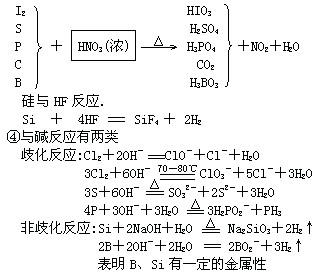
2、氢化物:
(1)气态氢化物性质比较
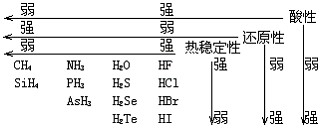
(2)由于氢键的存在,使得第ⅤA、ⅥA、ⅦA氢化物的熔沸点出现了反常。第ⅤA中:SbH3>NH3>AsH3>PH3;第ⅥA中: H2O>H2Te>H2Se>H2S;第ⅦA中HF>HI>HBr>HCl。
(3)气态氢化物水溶液的酸碱性及与水作用的情况。①HCl、HBr、HI溶于水成酸且都是强酸。②HF、H2S、H2Se、H2Te溶于水成酸且都是弱酸。③NH3溶于水成碱,氨水是弱碱。④PH3、AsH3、CH4与水不反应。⑤SiH4、B2H6与水作用时分解并放出H2。
3、非金属氧化物的通性:
(1)许多非金属低价氧化物有毒,如SO2、NO、NO2、CO等,注意不能随便排放于大气中。
(2)非金属氧化物(除SiO2外)大都是分子晶体,熔沸点相差不大。
(3)非金属氧化物大都为酸酐,相应的酸易溶于水,则氧化物易与水化合,反之水化反应难以进行。
(4)不成盐氧化物(如CO、NO)不溶于水,也不与碱反应。虽然NO2能与碱反应生成盐,但NO2不属于酸酐。
4、含氧酸
(1)同周期非金属元素最高价含氧酸从左到右酸性增强。
(2)氧化性:同种元素低价强于高价含氧酸.
如:HClO>HClO3>HClO4(稀)
H2SO3>H2SO4(稀)
HNO2>HNO3(稀)
(3)对于同种非金属形成的不同含氧酸,价态越高,酸性越强。其顺序如:HClO4>HClO3>HClO2>HClO,H2SO4>H2SO3。
(4)难挥发的H2SO4、H3PO4受热难分解;强氧化性的HNO3、HNO2、HClO见光或受热易分解;非氧化性的H2CO3、H2SO3易分解。强酸可制弱酸,难挥发性酸制挥发性酸。
(5)常见含氧酸的一般性质:
①H2SO4:无色粘稠的油状液体,强酸,沸点高,不挥发,稳定。浓硫酸有吸水性、脱水性和强氧化性。
②H2SO3:仅存在于溶液中,中强酸,不稳定。
③HClO4:在水溶液中相当稳定,最强无机酸,有强氧化性。
④HClO:仅存在于溶液中,是一种弱酸,有强氧化性和漂白性,极不稳定,遇光分解。⑤HNO3:无色液体,强酸,沸点低,易挥发,不稳定,易分解,有强氧化性。
⑥H3PO4:无色晶体,中强酸,难挥发,有吸水性,稳定,属于非氧化性酸。
⑦H2CO3:仅存在于溶液中,弱酸,不稳定。
⑧H2SiO3:白色固体,不溶于水,弱酸,不挥发,加热时可分解。
⑨常见酸的酸性强弱。强酸:HCl、HNO3、H2SO4;中强酸:H2SO3>H3PO4(H3PO4中强偏弱);弱酸:HF>CH3COOH>H2CO3>H2S>HClO>H2SiO3。
四、11种无机化学气体的制取和性质(O2、H2、Cl2、CO、NO、SO2、NO2、CO2、H2S、HCl、NH3)。
(1)利用氧化还原反应原理制取的气体有:O2、H2、Cl2、NO、NO2等。
(2)利用复分解制取的气体有:SO2、CO2、H2S、HCl、NH3等。
(3)可用启普发生器制取的气体有:H2、CO2、H2S等。
(4)只能用排气法收集的是:Cl2、SO2、NO2、CO2、H2S、HCl、NH3等。只能用排水法收集的气体是:NO、CO。
(5)使红色石蕊变蓝的气体是NH3;使石灰水变浑浊的气体是SO2和CO2;使品红溶液褪色的气体是SO2和Cl2;使高锰酸钾溶液和溴水褪色的气体有H2S和SO2。
(6)臭鸡蛋气味的气体是H2S;刺激性气味的气体有:Cl2、SO2、NO2、HCl、NH3等;毒性气体有:Cl2、CO、NO、SO2、NO2、H2S等。
(7)能在空气中燃烧的气体:H2S、CO、H2等
查看答案和解析>>
科目:高中化学 来源: 题型:
M、N、R、T为周期表中前四周期相邻两个周期的元素,且原子序数依次增大。已知T的次外层上电子没有排满,且该能层中成对电子数等于其它各能层上电子的总数;R和T在同一族;N的外围电子总数为6,均为未成对电子。根据以上信息,回答下列问题:
(1)T的元素符号为 ,在周期表中位于 族,N的价电子排布式为 。
(2)M和R两种元素组成的常见化合物有两种,其中一种可以单质之间进行化合,生成R的高价态化合物,请写出该反应的化学方程式: 。
(3)表面上附着氮原子的R可做为工业催化剂,下图为氮原子在R的晶面上的单层附着局部示意图(图中小黑色球代表氮原子, 灰色球代表R原子)。则图示颗粒表面上氮原子与R原子的个数比为 。

(4)T、N都有多种配合物,[T(NH3)3(H2O)M2]M是T配合物的一种,其中心离子的化合价为 ,配位数为 。N与甲基丙烯酸根的配合物为:
 该化合物中存在的化学键类型有 。甲基丙烯酸分子中C原子的杂化方式有 。
该化合物中存在的化学键类型有 。甲基丙烯酸分子中C原子的杂化方式有 。
查看答案和解析>>
科目:高中化学 来源: 题型:
(15分)
M、N、R、T为周期表中前四周期相邻两个周期的元素,且原子序数依次增大。已知T的次外层上电子没有排满,且该能层中成对电子数等于其它各能层上电子的总数;R和T在同一族;N的外围电子总数为6,均为未成对电子。根据以上信息,回答下列问题:
(1)T的元素符号为 ,在周期表中位于 族,N的价电子排布式为 。
(2)M和R两种元素组成的常见化合物有两种,其中一种可以单质之间进行化合,生成R的高价态化合物,请写出该反应的化学方程式: 。
(3)表面上附着氮原子的R可做为工业催化剂,下图为氮原子在R的晶面上的单层附着局部示意图(图中小黑色球代表氮原子, 灰色球代表R原子)。则图示颗粒表面上氮原子与R原子的个数比为 。
(4)T、N都有多种配合物,[T(NH3)3(H2O)M2]M是T配合物的一种,其中心离子的化合价为 ,配位数为 。N与甲基丙烯酸根的配合物为:
该化合物中存在的化学键类型有 。甲基丙烯酸分子中C原子的杂化方式有 。
查看答案和解析>>
科目:高中化学 来源:2011届吉林省高考复习质量监测(理综)化学部分 题型:填空题
(15分)
M、N、R、T为周期表中前四周期相邻两个周期的元素,且原子序数依次增大。已知T的次外层上电子没有排满,且该能层中成对电子数等于其它各能层上电子的总数;R和T在同一族;N的外围电子总数为6,均为未成对电子。根据以上信息,回答下列问题:
(1)T的元素符号为 ,在周期表中位于 族,N的价电子排布式为 。
(2)M和R两种元素组成的常见化合物有两种,其中一种可以单质之间进行化合,生成R的高价态化合物,请写出该反应的化学方程式: 。
(3)表面上附着氮原子的R可做为工业催化剂,下图为氮原子在R的晶面上的单层附着局部示意图(图中小黑色球代表氮原子,灰色球代表R原子)。则图示颗粒表面上氮原子与R原子的个数比为 。
(4)T、N都有多种配合物,[T(NH3)3(H2O)M2]M是T配合物的一种,其中心离子的化合价为 ,配位数为 。N与甲基丙烯酸根的配合物为: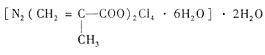 该化合物中存在的化学键类型有 。甲基丙烯酸分子中C原子的杂化方式有 。
该化合物中存在的化学键类型有 。甲基丙烯酸分子中C原子的杂化方式有 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com