
| A、苯中的C和SO2中的S都采取的是sp2杂化类型 |
| B、N2H4中的N和HClO中的O都采取的是sp3杂化类型 |
| C、乙烯发生加成反应时C原子杂化类型不会发生变化 |
| D、CS2和C2H2中的C都采取的是sp杂化类型 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:
| A、0.8molNa2CO3和0.6molNaOH |
| B、1molNa2CO3和1molNaOH |
| C、0.8molNa2CO3和1molNaOH |
| D、1molNa2CO3和0.6molNaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH为1的溶液:Ca2+、Na+、Mg2+、NO3- |
| B、滴加石蕊试液显红色的溶液:Fe3+、NH4+、Cl-、SCN- |
| C、与铝反应放出氢气的溶液:K+、HCO3-、Br-、Ba2+ |
| D、所含溶质为FeCl2的溶液:K+、SO42-、NO3-、H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②和① | B、②和④ |
| C、①和④ | D、③和① |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电池放电时,电池负极区溶液的碱性增强 |
| B、电池放电时,电子从Ag2O电极经外电路流向Zn电极 |
| C、Zn电极为负极,被氧化;Ag2O电极为正极,被还原 |
| D、Zn电极发生还原反应,Ag2O电极发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaHSO4在水溶液的电离方程式 NaHSO4?Na++H++SO42- |
| B、氯化铵在氘水中的水解离子方程式 NH4++D2O?NH3.HDO-+D+ |
| C、NaHS在水中的水解离子方程式 HS-+H2O?S2-+H3O+ |
| D、碳酸钙在水中的溶解平衡方程式 CaCO3=Ca2++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
 为了证明铜与稀硝酸反应产生一氧化氮,某校学生实验小组设计了一个实验,其装置如图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球.
为了证明铜与稀硝酸反应产生一氧化氮,某校学生实验小组设计了一个实验,其装置如图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球.查看答案和解析>>
科目:高中化学 来源: 题型:
 如图中P是可自由平行滑动的活塞.在相同温度时,向A容器中充入4mol SO3(g),关闭K,向B容器中充入2mol SO3(g),两容器分别发生反应.已知起始时容器A和B的体积均为a L.试回答:
如图中P是可自由平行滑动的活塞.在相同温度时,向A容器中充入4mol SO3(g),关闭K,向B容器中充入2mol SO3(g),两容器分别发生反应.已知起始时容器A和B的体积均为a L.试回答:查看答案和解析>>
科目:高中化学 来源: 题型:
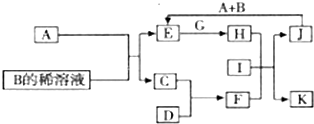 A-L为中学化学常见物质,其主要转化关系如下图所示(其中产物水已略去).已知A为金属单质,C、D通常状况下为气体单质.B、F均为重要的化工产品,0.05mol/LB的溶液pH=1,F具有刺激性气味的气体,将一定量F通入B的稀溶液中可以得到两种盐K和L.G和I分别由相同的两种元素组成,通常状况下均为无色液体.
A-L为中学化学常见物质,其主要转化关系如下图所示(其中产物水已略去).已知A为金属单质,C、D通常状况下为气体单质.B、F均为重要的化工产品,0.05mol/LB的溶液pH=1,F具有刺激性气味的气体,将一定量F通入B的稀溶液中可以得到两种盐K和L.G和I分别由相同的两种元素组成,通常状况下均为无色液体.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com