
【题目】青海昆仑玉被定为08北京奥运会奖牌用玉,昆仑玉主要成分是由“透闪石”和“阳起石”组成的纤维状微晶结合体,透闪石(Tremolite)的化学成份为Ca2Mg5Si8O22(OH)2。下列有关说法不正确的是
A.透闪石的化学式写成氧化物的形式为:2CaO·5MgO·8SiO2·H2O
B.透闪石的化学式写成硅酸盐的形式为:2CaSiO3·5MgSiO3·H2SiO3
C.透闪石中Mg元素的质量分数是Ca元素质量分数的2倍
D.透闪石中还可能有少量的Al代替Mg,Na、K、Mn代替Ca、Mg等。
【答案】C
【解析】
硅酸盐改写原则为:活泼的金属氧化物—不活泼的金属氧化物—二氧化硅—水,改写过程要遵循原子守恒,据此进行分析。
A.根据硅酸盐改写原则及原子守恒规律可知,Ca2Mg5Si8O22(OH)2写成氧化物的形式为:2CaO·5MgO·8SiO2·H2O,故A正确;
B.根据原子守恒及化合价不变规律,透闪石(Ca2Mg5Si8O22(OH)2)的化学式写成硅酸盐的形式为:2CaSiO3·5MgSiO3·H2SiO3,故B正确;
C.透闪石中Mg元素的质量分数是![]() ×100%,Ca元素质量分数是
×100%,Ca元素质量分数是![]() ×100%,所以Mg元素的质量分数:Ca元素质量分数=3:4,Mg元素的质量分数是Ca元素质量分数的0.75倍,故C错误;
×100%,所以Mg元素的质量分数:Ca元素质量分数=3:4,Mg元素的质量分数是Ca元素质量分数的0.75倍,故C错误;
D.透闪石中还可能有少量的Al代替Mg,Na、K、Mn代替Ca、Mg等,故D正确;
故答案选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增大,W原子的最外层电子数是其质子数的![]() ,X原子的核电荷数等于Z原子的最外层电子数,元素Y的最高正化合价为+2价。下列说法正确的是( )
,X原子的核电荷数等于Z原子的最外层电子数,元素Y的最高正化合价为+2价。下列说法正确的是( )
A.单质的沸点:W<X
B.简单离子的半径:Z>Y
C.X、Z的氧化物对应的水化物均为强酸
D.X、Y可形成离子化合物X3Y2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家正在研究温室气体CH4和CO2的转化和利用。
(1)O原子核外电子的运动状态有____种。
(2)CH4和CO2所含的三种元素电负性从小到大的顺序为____。
(3)下列关于CH4和CO2的说法正确的是____(填序号)。
a.固态CO2属于分子晶体,在晶体中一个CO2分子周围有12个紧邻的CO2分子
b.CH4分子中含有极性共价键,是极性分子
c.因为碳氢键键能小于碳氧键,所以CH4熔点低于CO2
d.CH4和CO2分子中碳原子的杂化类型分别是sp3和sp
(4)在Ni基催化剂作用下,CH4和CO2反应可获得化工原料CO和H2
①基态Ni原子的电子排布式为____,该元素位于元素周期表的第____周期____族。
②Ni能与CO形成正四面体形的配合物Ni(CO)4,1mol Ni(CO)4中含有____mol σ键。
(5)一定条件下,CH4和CO2都能与H2O形成笼状结构(如图所示)的水合物晶体,其相关参数见下表。CH4与H2O形成的水合物俗称“可燃冰”。
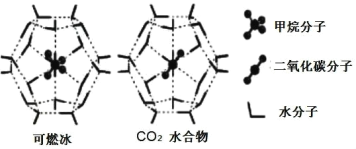
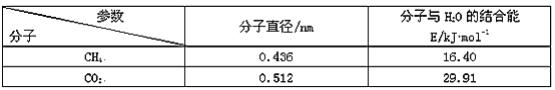
①“可燃冰”中分子间存在的2种作用力是____。
②为开采深海海底的“可燃冰”,有科学家提出用CO2置换CH4的设想。已知图中笼状结构的空腔直径为0.586nm,根据上述图表,从物质结构及性质的角度分析,该设想的依据是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法正确的是
A. (CH3)3C-CH=CH2与氢气完全反应后,生成2,2,3-三甲基戊烷
B. 工业上由乙烯制乙醇、苯制环己烷均属于加成反应
C. C5H11Cl的同分异构体有3种
D.  分子中所有碳原子一定在同一平面上
分子中所有碳原子一定在同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g);ΔH=+QkJ·mol-1(Q>0),某温度、压强下,将一定量反应物通入密闭容器进行以上反应,下列叙述正确的是( )
Si(s)+4HCl(g);ΔH=+QkJ·mol-1(Q>0),某温度、压强下,将一定量反应物通入密闭容器进行以上反应,下列叙述正确的是( )
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1mol,则达平衡时,吸收热量为QkJ
C.反应至4min时,若HCl浓度为0.12mol·L-1,则H2反应速率为0.03mol·L-1·min-1
D.当反应吸收热量为0.025QkJ时,生成的HCl通入100mL1mol·L-1的NaOH溶液恰好反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2008年北京奥运会“祥云”奥运火炬所用环保型燃料为丙烷(C3H8),悉尼奥运会所用火炬燃料为65%丁烷(C4H10)和35%丙烷,已知:
CO:2CO(g)+O2(g)=2CO2(g),△H=-566.0 kJ/mol
丙烷:C3H8(g)+5O2(g)=3CO2(g)+4H2O(l),△H=-2221.5 kJ/mol
正丁烷:C4H10(g)+6.5O2(g)=4CO2(g)+5H2O(l),△H=-2878.0kJ/mol
异丁烷:C4H10(g)+6.5O2(g)=4CO2(g)+5H2O(l),△H=-2869.6kJ/mol
下列有关说法正确的是( )
A.常温下,正丁烷的燃烧热为-2878.0kJ/mol
B.相同质量的丙烷和正丁烷分别完全燃烧,前者需要的氧气多产生的热量也多
C.常温下,CO的燃烧热为566.0 kJ/mol
D.人类利用的能源都是通过化学反应获得的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过反应“P4(s)+3NaOH(aq)+3H2O(l)=3NaH2PO2(aq)+PH3(g) ΔH>0”,能制得用于化学镀镍的NaH2PO2。P4的结构如图所示,则下列说法正确的是
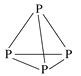
A.白磷中各P原子通过共价键相连接形成共价晶体
B.H2O分子的立体构型为V形
C.该反应能自发进行,则ΔS<0
D.反应产物PH3中磷原子的杂化方式为sp3杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷是天然气的主要成分,是一种重要的清洁能源和化工原料。
(1)用煤制天然气时会发生多个反应,通过多种途径生成CH4。
已知:C(s)十2H2(g) ![]() CH4(g) △H=-73kJ/mol
CH4(g) △H=-73kJ/mol
2CO(g) ![]() C(s)+CO2(g) △H=-171kJ/mol
C(s)+CO2(g) △H=-171kJ/mol
CO(g)十3H2(g) ![]() CH4(g)+H2O(g) △H=-203kJ/mol。
CH4(g)+H2O(g) △H=-203kJ/mol。
写出CO(g) 与H2O(g) 反应生成H 2(g) 和CO2(g) 的热化学方程式____________。
(2)天然气中含有H2S杂质,某科研小组用氨水吸收得到NH4HS溶液,已知T℃k(NH3·H2O) =1.74×10-5; k1(H2S) =1.07×10-7, k2(H2S) =1.74×10-13,NH4HS溶液中所含粒子浓度大小关系正确的是____________。
A c(NH4+)>c(HS-)>c(OH-) >c(H+)
B c(HS-) > c(NH4+)> (S2-) >c(H+)
C c(NH4+)>c(HS-) >c(H2S) >c(H+)
D c(HS-) >c(S2-) >c(H+)>c(OH-)
(3)工业上常用CH4与水蒸气在一定条件下来制取H2,其原理为: CH4(g)+H2O(g) ![]() CO(g)+3H2(g)
CO(g)+3H2(g)
①一定温度时, 在一个体积为2L的恒容密闭容器中, 加入1molCH4和1.4mol水蒸气发生上述反应, 5min后达平衡, 生成0.2mol CO, 用H2表示该反应的速率为____________。此反应的平衡常数为____________(结果保留到小数点后三位)。
②下列说法中能说明此反应达到平衡状态的是____________。
A 体系的压强不再发生变化
B 生成1molCH4的同时消耗3molH2
C 各组分的物质的量浓度不再改变
D 体系的密度不再发生变化
E 反应速率V(CH4):V(H2O):u(CO):u(H2)=1:1:1:3
(4)甲醇水蒸气重整制氢反应:CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49kJ/mol。某温度下, 将[n(H2O) :n(CH3OH) ] =1:1的原料气充入恒容密闭容器中,初始压强为p1,反应达到平衡时总压强为p2,则平衡时甲醇的转化率为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.一般沉淀离子浓度小于10-5mol·L-1时,则认为已经沉淀完全
B.反应AgCl+NaBr=AgBr+NaCl能在水溶液中能进行,是因为AgCl比AgBr更难溶于水
C.Al(OH)3(s)![]() Al3+(aq)+3OH-(aq)表示沉淀溶解平衡,Al(OH)3
Al3+(aq)+3OH-(aq)表示沉淀溶解平衡,Al(OH)3![]() Al3++3OH-表示水解平衡
Al3++3OH-表示水解平衡
D.只有反应速率很高的化学反应才能应用于工业生产
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com