
在25℃时,将pH=11的NaOH溶液与pH=3的CH3COOH溶液等体积混合后,下列关系式中正确的是( )
A.[Na+]=[CH3COO-]+[CH3COOH]
B.[H+]=c(CH3COO-)+[OH-]
C.[Na+]>[CH3COO-]>[OH-]>[H+]
D.[CH3COO-]>[Na+]>[H+]>[OH-]
 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:
(1)以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是 。
a.电能全部转化为化学能
b.粗铜接电源正极,发生氧化反应
c.溶液中Cu2+向阳极移动
d.利用阳极泥可回收Ag、Pt、Au等金属
(2)利用反应2Cu+O2+2H2SO4====2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,其正极电极反应式为 _____。
Ⅱ.(2012·福建高考)(1)电镀时,镀件与电源的 极连接。
(2)化学镀的原理是利用化学反应生成金属单质沉积在镀件表面形成镀层。若用铜盐进行化学镀铜,应选用 (填“氧化剂”或“还原剂”)与之反应。
Ⅲ.(2012·重庆高考)尿素[CO(NH2)2]是首个由无机物人工合成的有机物。人工肾脏可采用间接电化学方法除去代谢产物中的尿素,原理如图。
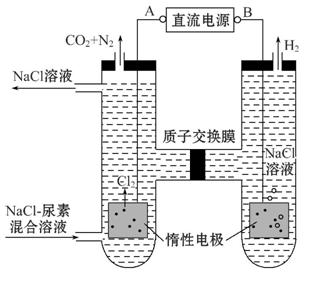
(1)电源的负极为 (填“A”或“B”)。
(2)阳极室中发生的反应依次为 、 。
(3)电解结束后,阴极室溶液的pH与电解前相比将 ;若两极共收集到气体13.44 L(标准状况),则除去的尿素为 g(忽略气体的溶解)。
查看答案和解析>>
科目:高中化学 来源: 题型:
用惰性电极分别电解下列各物质的水溶液,一段时间后,向剩余电解质溶液中加入适量相应的溶质能使溶液恢复到电解前浓度的是( )
A.AgNO3 B.Na2SO4 C.CuCl2 D.KCl
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示,若电解5 min时,测得铜电极的质量增加2.16 g。试回答:
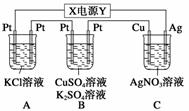
(1)电源中X极是__________(填“正”或“负”)极。
(2)通电5 min时,B中共收集到224 mL(标准状况)气体,溶液体积为200 mL(电解前后溶液的体积变化忽略不计),则通电前[CuSO4]=____________。
(3)若A中KCl溶液的体积也是200 mL,电解后溶液中仍有Cl-,则电解后溶液的pH=
__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子中,在溶液里能大量共存,且溶液为无色透明的是( )
A.NH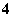 、NO
、NO 、Al3+、Cl-
、Al3+、Cl-
B.Na+、SiO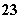 、NO
、NO 、Fe3+
、Fe3+
C.Na+、MnO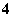 、K+、SO
、K+、SO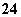
D.Na+、HCO 、SO
、SO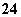 、Al3+
、Al3+
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,某水溶液M中存在的离子有Na+、A-、H+、OH-。根据题意回答下列问题:
(1)若溶液M由0.1 mol·L-1的HA溶液与0.1 mol·L-1的NaOH溶液等体积混合而得,则溶液M的pH不可能________7(填“大于”、“小于”或“等于”)。
(2)若溶液M的pH>7,则[Na+]________[A-](填“>”、“<”或“=”)。
(3)常温下,若溶液M由pH=3的HA溶液V1 mL与pH=11的NaOH溶液V2 mL混合反应而得,则下列说法中正确的是________(填字母)。
A.若溶液M呈中性,则溶液M中[H+]+[OH-]=2×10-7 mol·L-1
B.若V1=V2,则溶液M的pH一定等于7
C.若溶液M呈酸性,则V1一定大于V2
D.若溶液M呈碱性,则V1一定小于V2
查看答案和解析>>
科目:高中化学 来源: 题型:
某课外活动小组测定了某工厂工业废水中游离态氯的含量,下面是测定实验分析报告请填写有关空白):
一)测定目的:测定工厂工业废水中的游离态氯的含量
二)测定原理:Cl2+2KI===2KCl+I2;I2+2Na2S2O3===2NaI+Na2S4O6
三)实验用品及试剂:
1)仪器和用品自选,略)
2)试剂:指示剂________填名称),KI溶液,浓度为0.010 mol/L 的标准Na2S2O3溶液,蒸馏水等。
四)实验过程:
1)取水样10.00 mL 于锥形瓶中,加入10.00 mL KI溶液足量),滴入指示剂2~3滴。
2)取碱式滴定管经检查不漏水),依次用自来水、蒸馏水洗净,然后注入0.010 mL/L Na2S2O3溶液待用。
3)将锥形瓶置于滴定管下方进行滴定,眼睛注视______直至滴定终点,滴定至终点的现象是__________________________。
五)数据记录与处理:请在下面表格中的有括号的横线上填上必要的物理量,不必填数据)
| 滴定 次数 | ______) | ____________) | |||
| ______) | ______) | ______) | 平均值 | ||
| 1 | 10.00 | ||||
| 2 | 10.00 | ||||
| 3 | 10.00 |
若经数据处理,滴定中消耗标准的Na2S2O3溶液的体积平均是20.00 mL,则废水中Cl2的物质的量浓度为________,从实验过程分析,此浓度比实际浓度________填“偏大”、“偏小”或“相等”),造成误差的原因是
________________________________________________________若认为没有误差,该问可不答)。
六)问题和讨论:
实验结束后,发现个别同学结果误差较大,其所测游离态氯的含量较废水中Cl2的含量低。经过思考,该同学提出了下列可能造成结果偏小的原因,其中你认为正确的是________填编号)。
①滴定前,滴定管嘴尖嘴处有气泡,滴定后气泡消失
②滴定过程中由于振荡过于剧烈,使少量溶液溅出锥形瓶外
③滴定前平视Na2S2O3液面,滴定后俯视Na2S2O3液面
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关说法正确的是 )。
①如果某化合物只含共价键,则其一定是共价化合物 ②有阴离子存在的物质中一定存在阳离子 ③碳、氮形成的氢化物常温下都呈气态 ④非金属单质在反应中都只能作氧化剂,具有强氧化性 ⑤金属氧化物不一定是碱性氧化物 ⑥稀有气体不活泼是因为它们原子最外层都达到8电子稳定结构
A.①②⑤ B.②③④
C.①②⑥ D.②③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
下列根据实验操作和现象所得出的结论正确的是
( )
| 实验操作 | 现象 | 解释或结论 | |
| A | 向溶液X中先滴加稀硝酸,再滴加Ba(NO3)2溶液 | 出现白色沉淀 | 溶液X中一定含有SO |
| B | 等体积pH=3的HA和HB两种酸分别与足量的锌反应,排水法收集气体 | HA放出的氢气多且反应速率快 | HB酸性比HA强 |
| C | 在镁、铝为电极,氢氧化钠为电解质的原电池装置中 | 镁表面有气泡 | 金属活动性:Al>Mg |
| D | 向1 mL 1%的NaOH溶液中加入2 mL 2%的CuSO4溶液,振荡后加入0.5 mL有机物Y,加热 | 未出现砖红色沉淀 | Y中不含有醛基 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com