
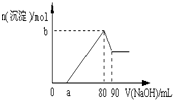
 把一块镁铝合金投入到1mol/L酸中,待合金完全溶解后,再往溶液里加入1mol/L NaOH溶液,生成沉淀的物质的量随加入NaOH溶液的体积变化的关系如图所示,下列说法中错误的是( )
把一块镁铝合金投入到1mol/L酸中,待合金完全溶解后,再往溶液里加入1mol/L NaOH溶液,生成沉淀的物质的量随加入NaOH溶液的体积变化的关系如图所示,下列说法中错误的是( )| A. | 盐酸的体积为80ml | B. | a的取值范围为0≤a<50 | ||
| C. | n(Mg2+)<0.025mol | D. | 当a值为30时,b值为0.01 |
分析 A.根据图中氢氧化钠的体积是80mL时溶质为氯化钠确定盐酸的体积;
B.根据第三阶段的反应确定铝离子的物质的量,假设只有铝离子时,根据消耗的氢氧化钠来确定a的取值范围;
C.根据图示知第四阶段无反应,沉淀全为Mg(OH)2,若a=0,n(Mg2+)取得最大值,据此来计算镁离子物质的量的范围;
D.根据a=30时,先确定镁离子消耗的氢氧化钠的量,再根据b点的含义来计算回答.
解答 解:A.第一阶段,盐酸和氢氧化钠反应:H++OH-=H2O;第二阶段,氯化镁和氯化铝和氢氧化钠反应Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓,在V(NaOH)=80mL时,溶液中溶质全为NaCl,所以盐酸的体积为80mL,故A正确;
B.第三阶段,氢氧化铝溶解Al(OH)3+NaOH=NaAlO2+2H2O,因为此时消耗NaOH10mL,所以n(Al3+)=0.01mol,和Al3+反应的NaOH为30mL,因为第一阶段和Al3+反应的NaOH为30mL,假设无Mg2+,a=50,而实际存在Mg2+,所以0<a<50,故B正确;
C.第三阶段,氢氧化铝溶解Al(OH)3+NaOH=NaAlO2+2H2O,因为此时消耗NaOH10mL,所以n(Al3+)=0.01mol,第四阶段无反应,沉淀全为Mg(OH)2,若a=0,n(Mg2+)取得最大值,第一阶段,和Al3+反应的NaOH为30mL,所以此时和Mg2+反应的NaOH为50ml,(Mg2+)max=0.025mol,而如图所示a>0,所以n(Mg2+)<0.025mol,故C正确;
D.a=30时,和Mg2+反应的NaOH为20ml,此时n(Mg2+)=0.01mol,b=n(Mg2+)+n(Al3+)=0.02mol,故D错误;
故选D.
点评 本题考查了混合物反应的计算,题目难度中等,明确曲线中发生反应及溶质组成为解答关键,试题侧重考查学生的分析、理解能力及化学计算能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=3的溶液与pH=11的溶液混合后pH值不一定等于7 | |
| B. | 同浓度的Na2CO3溶液室温时的pH值必定大于60℃的pH值 | |
| C. | 同浓度的钾盐溶液,酸式盐的pH值必定小于对应正盐的pH值 | |
| D. | 因为碳酸的酸性比亚硫酸弱,所以室温下同浓度的碳酸钠溶液的pH值小于亚硫酸钠溶液pH值 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
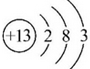
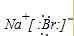 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠熔化成小球 | |
| B. | 钠块沉在乙醇液面的下面 | |
| C. | 钠块在乙醇的液面上游动 | |
| D. | 钠块表面有气泡放出,有轻微爆炸产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除②以外 | B. | 除④以外 | C. | 除⑤以外 | D. | 全部正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
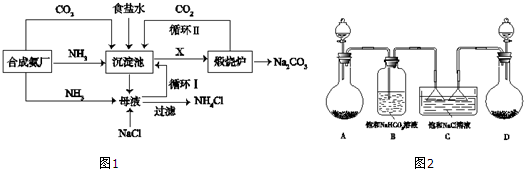
 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 |
| NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | - |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验事实 | 推论 |
| A | H2O的沸点比H2S的沸点高 | 非金属性:O>S |
| B | 盐酸的酸性比H2SO3的酸性强 | 非金属性:Cl>S |
| C | 钾与水的反应比钠与水的反应更剧烈 | 金属性:Na>K |
| D | HF的热稳定性比HCl的强 | 非金属性:F>Cl |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com