
W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可与其最高价含氧酸反应生成离子化合物,由此可知
( )
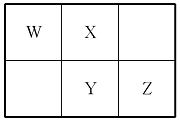
A.X、Y、Z中最简单氢化物稳定性最弱的是Y
B.Z元素氧化物对应水化物的酸性一定强于Y
C.X元素形成的单核阴离子还原性大于Y
D.Z元素单质在化学反应中只表现氧化性
选A。W的气态氢化物可与其最高价含氧酸形成离子化合物,故其气态氢化物具有碱性,为NH3,故W为N,根据四种元素在周期表中的位置关系,可推知X为O,Y为S,Z为Cl。四种元素的非金属性强弱顺序为S<Cl<N<O,元素非金属性越强,气态氢化物越稳定,故稳定性最弱的氢化物为H2S,A项正确;氯元素对应的氧化物的水化物有多种,如HClO、HClO4等,硫元素的氧化物的水化物也有多种,可能为H2SO4、H2SO3等,其酸性HClO4>H2SO4>H2SO3>HClO,B项错误;硫元素的非金属性小于氧元素,故还原性O2-<S2-,C项错误;Cl2中氯元素化合价为中间价态,可以表现出氧化性和还原性,D项错误。


 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:
化学式为C4H8O3的有机物,在浓硫酸存在和加热时,有如下性质:
①能分别与CH3CH2OH和CH3COOH反应;
②脱水生成一种能使溴水褪色的物质,此物质只存在一种结构简式;
③能生成一种分子式为C4H6O2的五元环状化合物。则C4H8O3的结构简式为( )
A.HOCH2COOCH2CH3 B.CH3CH(OH)CH2COOH
C.HOCH2CH2CH2COOH D.CH3CH2CH(OH)COOH
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,0.2 mol/L CH3COOH溶液与0.1 mol/L NaOH溶液等体积混合后(忽略混合前后溶液体积的变化),溶液的pH < 7,则下列有关此溶液叙
述不正确的是
A.溶液中由水电离产生的H+浓度小于1×10-7 mol/L
B.溶液中CH3COOH的电离程度大于CH3COONa的水解程度
C.c(CH3COO¯ ) + c(CH3COOH)-c(Na+) = 0.1 mol/L
D.溶液中离子浓度的大小关系为:c(CH3COO¯)>c(Na+)>c(H+)>c(OH¯)
查看答案和解析>>
科目:高中化学 来源: 题型:
铝镁合金是飞机制造、化工生产等行业的重要材料。研究性学习小组的同学为测定某含镁3%~5%的铝镁合金(不含其他元素)中镁的质量分数,设计了下列两种不同实验方案进行探究。
[方案一]
[实验方案] 将铝镁合金与足量NaOH溶液反应,测定剩余固体质量。
实验中发生反应的化学方程式是_______________________________。
[实验步骤]
(1)称取10.8 g铝镁合金粉末样品,溶于体积为V、物质的量浓度为4.0 mol·L-1的NaOH溶液中,充分反应。则NaOH溶液的体积V≥__________mL。
(2)过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将______________(填“偏高”、“偏低”或“无影响”)。
[方案二]
[实验方案] 将铝镁合金与足量稀硫酸溶液反应,测定生成气体的体积。
[实验步骤]
(1)同学们拟选用下列实验装置完成实验:
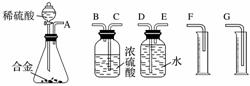
你认为最简易的装置其连接顺序是A接( )( )接( )( )接( )(填接口字母,可不填满)。

(2)仔细分析实验装置后,同学们经讨论认为以下两点会引起较大误差:稀硫酸滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小。于是他们设计了如图所示的实验装置。
①装置中导管a的作用是_____________________________________;
②实验前后量气管中液面读数分别为V1 mL、V2 mL,则产生氢气的体积为__________mL;
③若需确定产生氢气的量,还需测定的数据是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某课外活动小组设计了以下实验方案验证Ag与浓HNO3反应的过程中可能产生NO。其实验流程图如下:

(1)测定硝酸的物质的量
反应结束后,从下图B装置中所得100 mL溶液中取出25.00 mL溶液,用0.1 mol·L-1的NaOH溶液滴定,用酚酞作指示剂,滴定前后的滴定管中液面的位置如右上图所示。
在B容器中生成硝酸的物质的量为__________,则Ag与浓硝酸反应过程中生成的NO2的物质的量为____________。
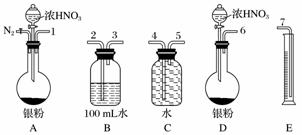
(2)测定NO的体积
①从上图所示的装置中,你认为应选用________装置进行Ag与浓硝酸反应实验,选用的理由是________________________________________________________________________。
②选用上图所示仪器组合一套可用来测定生成NO体积的装置,其合理的连接顺序是__________________(填各导管口编号)。
③在读取量筒内液体体积之前,应进行的操作______________________________________________。
(3)气体成分分析
若实验测得NO的体积为112.0 mL(已折算到标准状况),则Ag与浓硝酸反应的过程中________(填“有”或“没有”)NO产生,作此判断的依据是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
)四种短周期元素W、X、Y、Z,原子序数依次增大,请结合表中信息回答下列问题。
| W | X | Y | Z | |
| 结构或性质 | 最高价氧化物对应的水化物与其气态氢化物反应得到离子化合物 | 焰色反应呈黄色 | 在同周期主族元素形成的简单离子中,离子半径最小 | 最高正价与最低负价之和为零 |
(1)Z在元素周期表中位于 族。
(2)上述元素的最高价氧化物对应的水化物中,有一种物质在一定条件下均能与其他三种物质发生化学反应,该元素是 (填元素符号)。
(3)①下列可作为比较X和Y金属性强弱的依据的是 (填序号)。
a.自然界中的含量
b.相应氯化物水溶液的pH
c.单质与水反应的难易程度
d.单质与酸反应时失去的电子数
②从原子结构的角度解释X的金属性强于Y的原因:______________________,
原子半径X>Y,所以原子核对最外层电子的吸引力X<Y,失电子能力X>Y。
(4)W的一种氢化物HW3可用于有机合成,其酸性与醋酸相似。体积和浓度均相等的HW3与X的最高价氧化物对应的水化物的溶液混合,反应的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
在pH=1的溶液中可以大量共存的离子组是( )
A.K+、Na+、SO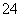 、S2-
、S2-
B.NH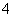 、Mg2+、SO
、Mg2+、SO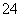 、Cl-
、Cl-
C.Na+、K+、HCO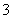 、Cl-
、Cl-
D.K+、Na+、[Al(OH)4]-、NO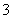
查看答案和解析>>
科目:高中化学 来源: 题型:
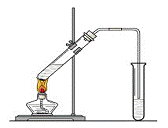 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如右图所示的装置制取乙酸乙酯。回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如右图所示的装置制取乙酸乙酯。回答下列问题:
(1)写出制取乙酸乙酯的化学反应方程式
(2)浓硫酸的作用是:① ;② 。
(3)饱和碳酸钠溶液的主要作用是
。
装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是 。
若要把制得的乙酸乙酯分离出来,应采用的实验操作是
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com