
【题目】(2013·北江中学月考)将下列物质分别装入有水的锥形瓶里,立即塞紧带U形管的塞子,发现U形管内滴有红墨水的水面呈现如图所示状态。加入的物质不可能是(不考虑加入物质引起的溶液体积的变化)
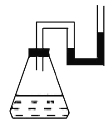
A.固体NaOH B.浓H2SO4
C.Ba(OH)2·8H2O与NH4Cl糊状物 D.CaO固体
 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:高中化学 来源: 题型:
【题目】下列有关同分异构体数目的叙述中,正确的是( )
A.戊烷有2种同分异构体
B.C8H10中只有3种属于芳香烃的同分异构体
C.甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有6种
D.CH3CH2CH2CH3光照下与氯气反应,只生成1种一氯代烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳及其化合物广泛存在于自然界。请回答下列问题:
(1)反应Ⅰ:Fe(s)+CO2(g) ![]() FeO(s)+CO(g) ΔH1 平衡常数为K1,反应Ⅱ:Fe(s)+H2O(g)
FeO(s)+CO(g) ΔH1 平衡常数为K1,反应Ⅱ:Fe(s)+H2O(g) ![]() FeO(s)+H2(g) ΔH2 平衡常数为K2,不同温度下,K1、K2的值如下表:
FeO(s)+H2(g) ΔH2 平衡常数为K2,不同温度下,K1、K2的值如下表:
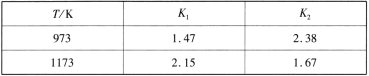
现有反应Ⅲ:H2(g)+CO2(g) ![]() CO(g)+H2O(g),结合上表数据,反应Ⅲ是___ (填“放热”或“吸热”)反应。
CO(g)+H2O(g),结合上表数据,反应Ⅲ是___ (填“放热”或“吸热”)反应。
(2)已知CO2催化加氢合成乙醇的反应原理为:2CO2(g)+6H2(g) ![]() C2H5OH(g)+3H2O(g) H<0。设m为起始时的投料比,即m= n(H2)/ n(CO2)。
C2H5OH(g)+3H2O(g) H<0。设m为起始时的投料比,即m= n(H2)/ n(CO2)。
图1 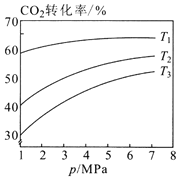 图2
图2 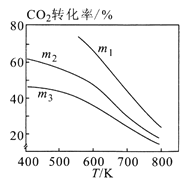 图3
图3 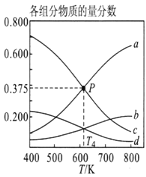
①图1中投料比相同,温度从高到低的顺序为________。
②图2中m1、m2、m3从大到小的顺序为________。
③图3表示在总压为5MPa的恒压条件下,且m=3时,平衡状态时各物质的物质的量分数与温度的关系。则曲线d代表的物质化学名称为__________。
(3)为了测量某湖水中无机碳含量,量取100mL湖水,酸化后用N2吹出CO2,再用NaOH溶液吸收。往吸收液中滴加1.0mol/L盐酸,生成的V(CO2)随V(盐酸)变化关系如图所示,则原吸收液中离子浓度由大到小的顺序为__________。
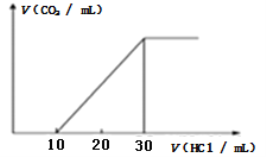
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水溶液是中学化学的重点研究对象。
(1)水是极弱的电解质,也是最重要的溶剂。常温下某电解质溶解在水中后,溶液中的c(H+)=10-9 mol·L-1,则该电解质可能是____(填序号)。
A.CuSO4 B.HCl C.Na2S D.NaOH E.K2SO4
(2)已知次氯酸是比碳酸还弱的酸,要使新制稀氯水中的c(HClO)增大,可以采取的措施为(回答两种)____,_____。
(3)常温下,将pH=3的盐酸aL分别与下列三种溶液混合,结果溶液均呈中性。
①浓度为1.0×10-3mol·L-1的氨水bL;
②c(OH-)=1.0×10-3mol·L-1的氨水cL;
③c(OH-)=1.0×10-3mol·L-1的氢氧化钡溶液dL
则a、b、c、d之间的大小关系是___。
(4)已知:H2A=H++HA-,HA-![]() H++A2-。常温下,0.1mol·L-1的NaHA溶液其pH=2,则0.1mol·L-1的H2A溶液中氢离子浓度的大小范围是___<c(H+)<___;NaHA溶液中各种离子浓度大小关系为____。
H++A2-。常温下,0.1mol·L-1的NaHA溶液其pH=2,则0.1mol·L-1的H2A溶液中氢离子浓度的大小范围是___<c(H+)<___;NaHA溶液中各种离子浓度大小关系为____。
(5)已知:Ksp(AgCl)=1.8×10-10,向50 mL0.018mol·L-1的AgNO3溶液中加入相同体积0.020mol·L-1的盐酸,所得混合溶液的pH=___,c(Ag+)=____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知乙醇、石墨和氢气的燃烧热分别为a、b、c(均为正值,单位均为kJ·mol-1)。则反应2C(s,石墨)+2H2(g)+H2O(l)==C2H5OH(l)的焓变为( )
A. (2b+2c-a) kJ·mol-1 B. (b+c-a) kJ·mol-1
C. (a-2b-2c) kJ·mol-1 D. (a-2b-c) kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取一张用饱和的NaCl溶液浸湿的pH试纸,两根铅笔芯作电极,接通直流电源,一段时间后,发现a电极与试纸接触处出现一个双色同心圆,内圈为白色,外圈呈浅红色。则下列说法错误的是( )

A. b电极是阴极B. a电极与电源的正极相连
C. 电解过程中水是氧化剂D. b电极附近溶液的pH变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理在化学工业中有广泛应用。如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。
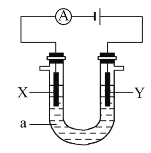
请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则:
①电解池中X极上的电极反应式为_______,在X极附近观察到的现象是_________
②Y电极上的电极反应式为_____________ 检验该电极反应产物的方法及现象是__________
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则:
①X电极的材料是_________________电极反应式是_________________。
②Y电极的材料是___________电极反应式是__________________。(说明:杂质发生的电极反应不必写出)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肯定属于同族元素且性质相似的是
A. A原子基态时2p轨道上有一对成对电子,B原子基态时3p轨道上也有一对成对电子
B. 结构示意图:A为 ![]() ,B为
,B为![]()
C. A原子基态时2p轨道有1个未成对电子,B原子基态时3p轨道也有1个未成对电子
D. 原子核外电子排布式:A为1s22s2,B为1s2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(I)硫酸生产中,SO2催化氧化生成SO3:
2SO2(g)+O2(g)2SO3(g) ΔH<0某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如下图所示。根据图示回答下列问题:
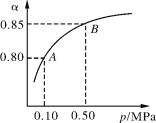
(1)将2.0 mol SO2和1.0 mol O2置于10 L密闭容器中,反应达平衡后,体系总压强为0.10 MPa。该反应的平衡常数等于 ______________________。(不需要写表达式)
(2)平衡状态由A变到B时,平衡常数K(A)___________ K(B)(填“>”、“<”或“=”)。
(3)此反应在恒温密闭的装置中进行,能充分说明此反应已达到平衡的标志是______。
A.接触室中气体的平均相对分子质量不再改变
B.接触室中SO2、O2、SO3的浓度相同
C.接触室中SO2、O2、SO3的物质的量之比为2∶1∶2
D.接触室中压强不随时间变化而变化
(II)已知工业制氢气的反应为CO(g)+H2O(g) CO2(g)+H2(g),反应过程中能量变化如下图所示。在500 ℃时的平衡常数K=9。若在2 L的密闭容器中CO和水蒸气的起始浓度都是0.1 mol/L,10 min时达到平衡状态。
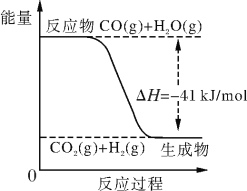
(4)增加H2O(g)的浓度,CO的转化率将________(填“增大”、“减小”或“不变”)。
(5)平衡常数的表达式K=_______。400 ℃时平衡常数K________9(填“>”、“<” 或“=”)。
(6)已知2H2(g)+O2(g) 2H2O (g) ΔH=-484 kJ/mol。结合上图写出CO完全燃烧生成CO2的热化学方程式:_____________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com