
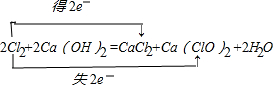 ,
,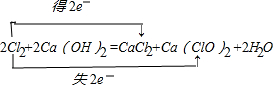 ;
;

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、二氧化碳分子中存在共价键和分子间作用力 |
| B、甲烷、氨和水都是由极性键结合而成的极性分子 |
| C、同主族不同元素的最高价氧化物,一定具有相同的晶体结构 |
| D、氟化氢的沸点高于氯化氢的沸点,正丁烷的沸点高于异丁烷的沸点 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钠和水反应 Na+H2O═Na++OH-+H2↑ |
| B、Cl2与KBr溶液反应 Cl2+2Br-═2Cl-+Br2 |
| C、氯气与NaOH溶液反应 Cl2+OH-═Cl-+ClO-+H2O |
| D、盐酸与石灰石反应 CO32-+2H+═CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
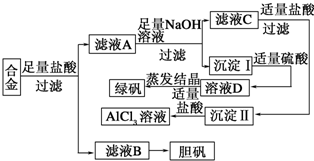
查看答案和解析>>
科目:高中化学 来源: 题型:

| 物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
| Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
查看答案和解析>>
科目:高中化学 来源: 题型:
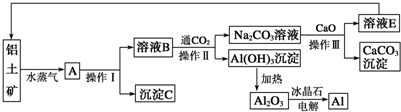
| ||
| 通电,Na3AlF6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com