
能正确表示下列反应的离子反应方程式为
A.大理石溶于醋酸溶液: CaCO3 + 2H+==Ca2+ + CO2 ↑+ H2O
B.向FeBr2溶液中通入足量氯气:2Fe2+ + 4Br- + 3Cl2=== 2Fe3+ + 2Br2 + 6Cl-
C.NH4HCO3溶于过量的NaOH溶液中: HCO3- + OH- === CO32- + H2O
D.向明矾(KAl(SO4)2·12H2O)溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2Al3+ + 3SO42- + 3Ba2+ + 6OH-=== 2Al(OH)3↓ + 3BaSO4↓
 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源:2015届广东省中山市高三上学期第二次模拟考试化学试卷(解析版) 题型:实验题
(14分)某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如下图所示:
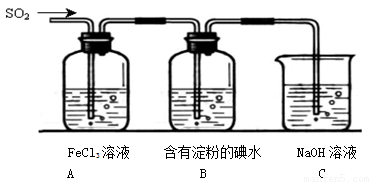
(1)装置C的作用是
(2) 若要从FeSO4溶液获得FeSO4?7H2O晶体,必须进行的实验操作步骤: 、 、过滤、洗涤、自然干燥。
(3)根据以上现象,该小组同学认为SO2 与 FeCl3溶液发生氧化还原反应。
①写出SO2与FeCl3溶液反应的离子方程式 ;
②请写出检验A烧杯中有Fe2+生成的操作方法 ;
③该小组同学向C烧杯反应后的溶液中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,即可证明反应生成了SO42-。该做法 (填“合理”或“不合理”),理由是 。
(4)能表明I-的还原性弱于SO2的现象是 。
查看答案和解析>>
科目:高中化学 来源:2015届广东省东莞市高三第一次调研考试理科化学试卷(解析版) 题型:选择题
下述实验设计能够达到目的的是
选项 | 实验目的 | 实验设计 |
A | 证明Ksp(AgCl)﹥Ksp(AgI) | 往AgCl悬浊液中滴入KI浓溶液 |
B | 除去Cu粉中的CuO | 向混合物中滴加适量稀硝酸 |
C | 检验溶液中是否含有Fe2+ | 向溶液中滴入KSCN溶液,再滴加氯水 |
D | 证明H2CO3酸性比H2SiO3强 | Na2CO3和SiO2在高温下熔融反应 |
查看答案和解析>>
科目:高中化学 来源:2015届广东省七校高三上学期第一次联考理综化学试卷(解析版) 题型:选择题
设nA为阿伏伽德罗常数的数值,下列说法正确的是
A.常温常压下,8gO2含有2nA个电子
B.10L 0.1mol·L-1的氨水中有nA个NH4+
C.标准状况下,22.4L盐酸含有nA个HCl分子
D.1molNa与足量氧气反应生成Na2O和Na2O2的混合物,失去nA个电子
查看答案和解析>>
科目:高中化学 来源:2015届山西省高三上学期期中考试化学试卷(解析版) 题型:选择题
氯酸是一种强酸,浓度超过40%时会发生分解,反应可表示为
a HClO3 = bO2↑+ c Cl2↑+ d HClO4 + e H2O。下列有关说法不正确的是
A.由反应可确定:氧化性HClO3>O2
B.若氯酸分解所得混合气体,lmol混合气体质量为45g,则反应方程式可表示为:3HClO3 = 2O2↑+ C12↑+ HClO4 + H2O
C.由非金属性Cl>S,可推知酸性HClO3>H2SO4
D.若化学计量数a=8,b=3,则该反应转移电子数为20e-
查看答案和解析>>
科目:高中化学 来源:2015届山西省高三上学期期中考试化学试卷(解析版) 题型:选择题
下列各组离子在碱性条件下能大量共存,而在强酸性条件下能发生氧化还原反应的是
A.Mg2+、Na+、SO42-、Cl—
B.K+、CO32-、Cl—、NO3—
C.NH4+、Na+、SO42-、NO3—
D.Na+、K+、NO3—、SO32—
查看答案和解析>>
科目:高中化学 来源:2015届山东省高三上学期第二次月考联考化学试卷(解析版) 题型:实验题
6分)制备Cl2需用8 mol?L-1的盐酸100mL,现用12 mol?L-1的盐酸来配制。
①需要12 mol?L-1的盐酸的体积为 mL(精确到0.1 mL)
②为完成配制,除玻璃棒,小烧杯外,还需要选择的仪器为 。
A 100mL量筒 B托盘天平 C 100mL容量瓶 D.50mL容量瓶
E.10mL量筒 F.胶头滴管
③ 在容量瓶的使用方法中,下列操作中,不正确的是 (填写标号)。
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗
C. 配制溶液时用量筒量取浓盐酸后用玻璃棒引流入容量瓶中,缓慢加入蒸馏水到接近刻度线1cm~2cm处,用胶头滴管滴加蒸馏水直到凹液面的最低处和标线相平
D.定容后盖好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转和摇动多次
查看答案和解析>>
科目:高中化学 来源:2015届山东省高三上学期第二次月考联考化学试卷(解析版) 题型:选择题
阿伏加德罗常数用NA表示,下列叙述正确的是
①标准状况下,22.4L乙醇中含有的氧原子数目为NA
②1L1 mol·L-1NH4Cl溶液中NH4+数目为NA
③0.44gC3H8中含有的共价键总数目为0.1NA
④25℃时,1LpH=13的Ba(OH)2溶液中含有OH-数目为0.2NA
⑤6.4g的S2和S8混合物中,含硫原子总数为0.2NA
⑥11.2LCl2通入足量氢氧化钠溶液中充分反应,转移的电子数等于0.5NA
A.③⑤ B.②⑤ C.③④ D.⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com