
【题目】高铁酸钾(K2FeO4)是一种高效多功能水处理剂。实验室模拟工业生产K2FeO4的流程如下:
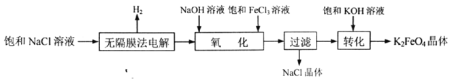
(1) K2FeO4既能杀菌消毒,又能沉降水中悬浮物,其原因是:_________________________________________。
(2)无隔膜法电解饱和NaCl溶液制备NaClO总反应的离子方程式为:__________________。
(3)“氧化”时发生反应的化学方程式为:_________________________________________。Na2FeO4、FeCl3、NaClO氧化性由强到弱的顺序为_________________________________。
(4)“过滤”所得滤液中,除OH-外,一定存在的阴离子为_____________________(填离子符号)。
(5) 试从沉淀溶解平衡的角度解释“转化”得以顺利实现的原因___________________________。
【答案】K2FeO4具有强氧化性,故能杀菌消毒,其还原产物Fe3+,水解产生Fe(OH)3胶体,吸附水中悬浮物产生沉降从而净水 Cl- + H2O ![]() H2↑+ClO- 3NaClO+2FeCl3+10NaOH=2Na2FeO4+9NaCl↓+5H2O NaClO>Na2FeO4>FeCl3 FeO42-、Cl- Na2FeO4溶液中加入饱和的氢氧化钾溶液,导致c2(K+)c(FeO42-)>Ksp(K2FeO4),析出K2FeO4
H2↑+ClO- 3NaClO+2FeCl3+10NaOH=2Na2FeO4+9NaCl↓+5H2O NaClO>Na2FeO4>FeCl3 FeO42-、Cl- Na2FeO4溶液中加入饱和的氢氧化钾溶液,导致c2(K+)c(FeO42-)>Ksp(K2FeO4),析出K2FeO4
【解析】
(1)K2FeO4具有强氧化性,故能杀菌消毒,其还原产物Fe3+,水解产生Fe(OH)3胶体,吸附水中悬浮物产生沉降从而净水;
(2)Cl- + H2O ![]() H2↑+ClO-;
H2↑+ClO-;
(3)3NaClO+2FeCl3+10NaOH=2Na2FeO4+9NaCl↓+5H2O;NaClO>Na2FeO4>FeCl3;
(4)FeO42-、Cl-;
(5)Na2FeO4溶液中加入饱和的氢氧化钾溶液,导致c2(K+)c(FeO42-)>Ksp(K2FeO4),析出K2FeO4
(1)K2FeO4具有强氧化性,故能杀菌消毒,其还原产物Fe3+,水解产生Fe(OH)3胶体,吸附水中悬浮物产生沉降从而净水;
(2)NaCl与水在电解条件下生成了NaClO和H2,无隔膜电解饱和氯化钠溶液的离子方程式为Cl- + H2O ![]() H2↑+ClO-;
H2↑+ClO-;
(3)根据流程信息写出NaClO+FeCl3+NaOH→Na2FeO4+NaCl↓,根据得失电子守恒配平得到3NaClO+2FeCl3+10NaOH=2Na2FeO4+9NaCl↓+5H2O;根据氧化剂的氧化性大于氧化产物的氧化性,氧化性:NaClO>Na2FeO4;由(1)可知,氧化性:Na2FeO4>FeCl3,故氧化性:NaClO>Na2FeO4>FeCl3;
(4)根据流程图知,氧化操作的产物是Na2FeO4和NaCl,虽然NaCl结晶析出,但滤液仍然是NaCl的饱和溶液,故滤液中所含阴离子除OH-外,一定存在的阴离子为FeO42-、Cl-;
(5)转化过程中发生的化学方程式为:Na2FeO4+2KOH=K2FeO4↓+2NaOH,该反应能够进行的原因是K2FeO4的溶解度比Na2FeO4更小,Na2FeO4溶液中加入饱和的氢氧化钾溶液,导致c2(K+)c(FeO42-)>Ksp(K2FeO4),析出K2FeO4。


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
【题目】1mol酯R完全水解可得到l molC5H8O4和2mol甲醇,下列有关酯R的分子式和分子结构数目正确的是
A. C7H12O4,4种 B. C7H12O4,6种
C. C7H14O2,8 种 D. C7H14O2,10种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)甲醇是一种可再生能源,用途广泛,一种由甲醇、氧气以及强碱溶液制成的新型手机电池,容量达氢镍电池或锂电池的10倍。回答下列有关问题:
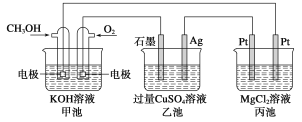
如图所示:
①甲池通入CH3OH的电极反应式为__________;乙池石墨一极的电极反应式为______;
②反应一段时间后,向乙池中加入一定量________能使CuSO4溶液恢复到原浓度;
③甲池中消耗280 mL(标准状况下)O2,此时丙池中理论上最多产生__________g沉淀。
(2)工业上有一种生产甲醇的反应:CO2(g) + 3H2(g)![]() CH3OH(g) + H2O(g) △H=-49.0kJ·mol-1。在某温度下,容积均为2L的A、B两个容器中,按不同方式投入反应物,保持恒温恒容,经10秒钟后达到平衡,达到平衡时的有关数据如下表:
CH3OH(g) + H2O(g) △H=-49.0kJ·mol-1。在某温度下,容积均为2L的A、B两个容器中,按不同方式投入反应物,保持恒温恒容,经10秒钟后达到平衡,达到平衡时的有关数据如下表:
容器 | A | B |
反应物投入量 | 1mol CO2(g)和3mol H2(g) | 1mol CH3OH(g)和1mol H2O(g) |
CH3OH(g)浓度(molL-1) | c1 | c2 |
反应能量变化 | 放出29.4kJ | 吸收akJ |
①从反应开始至达到平衡时,A中用CO2来表示的平均反应速率为______________;
②该温度下,反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)的化学平衡常数的值为_____________;
CH3OH(g)+H2O(g)的化学平衡常数的值为_____________;
③a=______________。
④下列措施中能使n(CH3OH)/n(CO2)增大的是____________。
A.升高温度 B.充入氢气
C.将水蒸气从体系中分离 D.用更有效的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知CaCO3和盐酸反应的化学方程式为CaCO3(s)+2HCl===CaCl2+H2O+CO2↑,下列措施中可使生成CO2的速率加快的是(不考虑CaCO3与盐酸接触面积改变的影响)
A. 加大CaCO3的量 B. 加大盐酸的浓度
C. 加大盐酸的量 D. 减小CaCl2的浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是:
A. 反应达到平衡时,X的转化率为50% B. 反应可表示为X+3Y![]() 2Z,其平衡常数为1600 C. 增大压强使平衡向生成Z的方向移动,平衡常数增大 D. 改变温度可以改变此反应的平衡常数
2Z,其平衡常数为1600 C. 增大压强使平衡向生成Z的方向移动,平衡常数增大 D. 改变温度可以改变此反应的平衡常数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 与足量的10mol/L硫酸液混合微热,产生下列现象:①有红色金属生成②产生刺激性气味的气体③溶液呈现蓝色。据此判断下列说法正确的是
与足量的10mol/L硫酸液混合微热,产生下列现象:①有红色金属生成②产生刺激性气味的气体③溶液呈现蓝色。据此判断下列说法正确的是
A. 反应中硫酸作氧化剂
B. ![]() 中硫元素被氧化
中硫元素被氧化
C. 刺激性气味的气体是氨气
D. 1mol![]() 完全反应转移0.5mol电子
完全反应转移0.5mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浙江大学的科研小组成功研制出能在“数分钟之内”将电量充满的锂电池,其成本只有传统锂电池的一半。他们把锂锰氧化物(LMO)浸泡在石墨里面,使其变成一个可以导电的密集网络的负极材料(如图),与电解质和正极材料(石墨)
构成可充电电池。若电解液为LiAlCl4-SOCl2,电池的总反应为:
4LiCl+S+SO2 ![]() 4Li+2SOCl2。下列说法正确的是( )
4Li+2SOCl2。下列说法正确的是( )
A.电池的电解液可为LiCl水溶液
B.该电池放电时,负极发生还原反应
C.充电时阳极反应式为:4Cl-+S+SO2-4e-=2SOCl2
D.放电时电子从负极经外电路流向正极,再从正极经电解质流向负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水开发利用的部分过程如图所示。下列说法错误的是

A. 向苦卤中通入Cl2是为了提取溴
B. 粗盐可采用除杂和重结晶等过程提纯
C. 工业生产中常选用NaOH作为沉淀剂
D. 富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com