
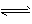 2NH3 ( g) △H = -a kJ . mol-1
2NH3 ( g) △H = -a kJ . mol-1 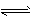 NH3(g) △H = -b kJ . mol-1
NH3(g) △H = -b kJ . mol-1  口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源:湖南师大附中2009届高三第五次月考化学试题 湘教版 湘教版 题型:058
氮化铝(AIN)是一种新型的无机材料,广泛应用于集成电路生产领域.某氮化铝样品中含有碳或氧化铝杂质,现用图Ⅰ装置进行实验,使氮化铝样品与NaOH溶液反应(AlN+NaOH+H2O![]() NaAlO2+NH3↑),根据反应所生成氨的体积来测定样品中氮化铝的质量分数,并根据实验现象确定杂质的成分.实验过程记录如下:
NaAlO2+NH3↑),根据反应所生成氨的体积来测定样品中氮化铝的质量分数,并根据实验现象确定杂质的成分.实验过程记录如下:
a.检查装置气密性;b.往锥形瓶中放入适量氮化铝样品,从分液漏斗往锥形瓶中加入过量浓NaOH溶液,立即发生剧烈反应,生成的氨将广口瓶中的水排入量筒中;c.实验结束后,测量量筒中收集到的水的体积(包括由广口瓶到量筒的导管内的水柱的体积),进行计算.
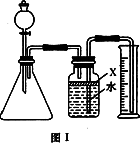
(1)本实验中,检查装置气密性的方法是________________.
(2)广口瓶中的试剂X宜选用________(填选项的标号).
A.丙烷
B.酒精
C.植物油
D.四氯化碳
(3)实验结束后,若观察到锥形瓶中还有固体,则样品中含有的杂质是________.
(4)若实验中测得样品的质量为w g,氨的体积为a L(已折算成标准状况),则样品中AlN的质量分数为________.
(5)有人改用图Ⅱ装置进行同样实验,通过测定烧杯中稀硫酸的增重来确定样品中AlN的质量分数.你认为两种实验方案中,比较好的是用________装置进行实验(填“图Ⅰ”或“图Ⅱ”).理由是______________.

查看答案和解析>>
科目:高中化学 来源:0104 期中题 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com