
【题目】氯化铜、氯化亚铜是重要的化工原料,广泛用作有机合催化剂。
已知:氯化铜容易潮解.

I.实验室用如图所示装置,用还原铜粉和氯气来制备氯化铜。
(1)石棉绒的作用是 ;B装置中的试剂是 。E和F装置及试剂可用_______ 替换(填装置及所装试剂)。
(2)当Cl2排尽空气后,加热D。则D中发生反应的化学方程式为 。
(3) 若实验测得CuCl2质量分数为90.0%,则其中可能含有的杂质是 (一种即可)。
Ⅱ.另取纯净CuC l2固体用于制备CuCl。

(4)溶解时加入HCl溶液的目的主要是 (结合离子方程式回答)。
(5)若接上述操作用10. 0mol/L的HCl代替0.2mol/L HCl,通人SO2后,200. 00mL黄绿色溶液颜色褪去,但无白色沉淀。对此现象:
甲同学提出假设:c(H+)过大。
为验证此假设,可取75.00g CuCl2固体与100mL0.2mol/LHCl及 mL9. 8mol/LH2SO4配制成200. 00mL溶液再按上述操作进行实验。
乙同学查阅资料:体系中存在平衡2Cl-(aq)+CuCl(s)=CuCl32-(aq)。则出现此现象另一可能的原因是 。
【答案】(1)增大铜粉与氯气的接触面积,和NaCl溶液,装有碱石灰(或生石灰)的干燥管
(2)Cu+Cl2![]() CuCl2
CuCl2
(3) 石棉绒(Cu或CuCl)
(4)Cu2++2H2O![]() Cu(OH)2+2H+, 加酸抑制Cu2+的水解
Cu(OH)2+2H+, 加酸抑制Cu2+的水解
(5)50 ,(Cl-) 过大
【解析】试题分析:I.(1)石棉绒的作用是增大铜粉与氯气反应的接触面积;氯气有毒,所以B装置是吸收尾气,而氯气用氢氧化钠吸收,故答案为:增大铜粉与氯气反应的接触面积;NaOH溶液;
(2)当Cl2排尽空气后,加热A,铜与氯气反应生成氯化铜,化学反应方程式为:Cu+Cl2![]() CuCl2;(3)若实验测得CuCl2质量分数为90.0%,可能含有的杂质是氯化亚铜或单质铜中的一种或两种;
CuCl2;(3)若实验测得CuCl2质量分数为90.0%,可能含有的杂质是氯化亚铜或单质铜中的一种或两种;
Ⅱ.(4)因为氯化铜是强酸弱碱盐,溶液中存在Cu2++2H2OCu(OH)2+2H+,所以溶解时加入HCl溶液,抑制氯化铜的水解;
(5)设9.8mol/LH2SO4的体积为VmL,则0.2×0.1+V×9.8×2=10×0.1,解之得V=50ml,体系中存在平衡2Cl-(aq)+CuCl(s)CuCl32-(aq),是氯离子的浓度过大平衡正向移动。


科目:高中化学 来源: 题型:
【题目】实验室以苯甲醛为原料制备间溴苯甲醛(实验装置主要部分见下图,相关物质的沸点见附表)。

附表相关物质的沸点(101kPa)

步骤1:将三颈瓶中的一定配比的无水AlCl3、1,2-二氯乙烷和苯甲醛充分混合后,升温至60℃,缓慢滴加经H2SO4干燥过的液溴,保温反应一段时间,冷却.
步骤2:将反应混合物缓慢加入一定量的稀盐酸中,_________________。
步骤3:有机相用10%NaHCO3溶液洗涤,再加入适量无水MgSO4固体,放置一段时间后过滤;
步骤4:减压蒸馏有机相,收集相应馏分。
(1)实验装置中可能的错误有______________,冷凝管进水口是______________;
(2)有同学建议将装置中温度计换成搅拌棒,那么温度计应移到什么地方使用______________;
(3)步骤2后续操作是_____________;
(4)步骤3中用10%NaHCO3溶液洗涤的具体操作是____________________,加入无水MgSO4固体的作用是______________。
(5)步骤4中采用蒸馏分离,请你预测蒸馏温度应先选择约_______℃,再选择约_______℃。
A.50 B.100 C.150 D.200 E.250 F.300
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求完成下列各小题实验.(a、b为弹簧夹,加热及固定装置已略去)

(1)验证碳、硅非金属性的相对强弱。(已知酸性:亚硫酸>碳酸)
① 实验步骤:连接仪器、 、加药品后,打开a关闭b,然后滴入浓硫酸,加热;
② 铜与浓硫酸反应的化学方程式 ,装置A中的试剂是 ;
③ 能说明碳的非金属性比硅强的实验现象是 ;
(2)验证SO2的氧化性、还原性和酸性氧化物的通性。
① 在(1)②操作后打开b,关闭a ;
② H2S溶液中有浅黄色浑浊出现,化学方程式是 ;
③ BaCl2溶液中无明显现象,将其分成两份,分别滴加下列溶液,将产生的沉淀的化学式填入下表中相应位置。

写出其中SO2显示还原性生成沉淀的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4molA气体和2molB气体在2L的密闭容器中混合,在一定条件下发生如下反应:2A(g)+B(g)![]() 2C(g)若经过2秒后测得C的浓度为0.6mol/L。
2C(g)若经过2秒后测得C的浓度为0.6mol/L。
则:(1)2s内用B表示的反应速率 。
(2)2s时A的物质的量浓度为 。
(3)2s时B的物质的量为 。
(4)最终C的浓度 (填“能”或“不能”)达到2mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼酸钠晶体( Na2MoO4·2H2O)是一种无公害型冷却水系统的金属缓蚀剂。工业上利用钼精矿(主要成分是不溶于水的MoS2)制备钼酸钠的两种途径如图所示:

(1) NaClO的电子式是
(2) 写出焙烧时生成MoO3的化学方程式为
(3)途径I碱浸时发生反应的化学反应方程式为
(4)途径Ⅱ氧化时发生反应的离子方程式为
(5)分析纯的钼酸钠常用钼酸铵[(NH4)2MoO4]和氢氧化钠反应来制取,若将该反应产生的气体与途径I所产生的尾气一起通入水中,得到正盐的化学式是
(6)钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如下图:

①要使碳素钢的缓蚀效果最优,钼酸钠和月桂酰肌氨酸的浓度比应为 。
②当硫酸的浓度大于90%时,腐蚀速率几乎为零,原因是 。
③试分析随着盐酸和硫酸浓度的增大,碳素钢在两者中腐蚀速率产生明显差异的主要原因是 。
(7)锂和二硫化钼形成的二次电池的总反应为:xLi + nMoS2![]() Lix(MoS2)n。则电池放电时的正极反应式是: 。
Lix(MoS2)n。则电池放电时的正极反应式是: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均使用镁片和铝片作电极,但甲同学将电极放入6mol/LH2SO4溶液中,乙同学将电极放入6mol/LNaOH溶液中,如图:
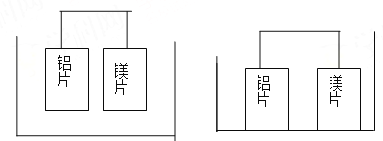
甲(H2SO4溶液) 乙(NaOH溶液)
(1)写出甲池中正极的电极反应式: ,负极的电极反应式: 。
(2)写出乙池中负极的电极反应式: ,乙池中总反应的离子方程式: 。
(3)如果甲和乙同学均认为,“构成原电池的电极材料如果都是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出 活动性更强,而乙会判断出 活动性更强。
(5)丙同学依据甲、乙同学的思路,设计如下实验:将铝片和铜片用导线相连.一组插入浓硝酸中,一组插入稀NaOH溶液中,分别形成了原电池。
①在这两个原电池中,负极分别为________。
A.铝片、铜片 B.铜片、铝片 C.铝片、铝片 D.铜片、铜片
②写出插入浓硝酸中形成原电池的总反应化学方程式__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用锌片、铜片、发光二极管、滤纸、导线等在玻璃片制成如图所示的原电池,当滤纸用醋酸溶液润湿时,二极管发光。下列有关该电池的说法正确的是( )

A.铜片上的电极反应:Cu2++2e﹣=Cu
B.电子通过溶液由锌片流向铜片
C.电池工作时电能直接转化为化学能
D.该电池工作时,若有16.25gZn被溶解,导线中转移0.50mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积不变的绝热密闭容器中,2molSO2与1molO2在催化剂作用下发生反应:2SO2(g)+O2(g)![]() 2SO3(g)△H=﹣QkJ/mol(Q>0)。当气体的物质的量减少0.5mol时反应达到平衡。下列叙述错误的是( )
2SO3(g)△H=﹣QkJ/mol(Q>0)。当气体的物质的量减少0.5mol时反应达到平衡。下列叙述错误的是( )
A.增大氧气浓度,平衡正向移动,平衡常数不变
B.降低温度,正反应速率比逆反应速率减小的程度小
C.平衡时SO2气体的转化率为50%
D.该条件下反应放出0.5QkJ的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 “侯氏制碱法”是我国化工行业历史长河中一颗璀璨明珠。
Ⅰ..纯碱的制备:用下图装置制取碳酸氢钠,再间接制得纯碱。

(1)装置乙的作用是 _________________,其中水可以用_______________代替;
(2)装置丙中反应的化学方程式为_____________________________________;
(3)用装置丙中产生的碳酸氢钠制取纯碱时,需要的实验操作有:_____________。
(4)定量分析:测定纯碱样品纯度
提供药品:酚酞、甲基橙、0.1mol/LHCl溶液
实验步骤:
①称取样品mg,溶于水形成100mL溶液;
②向溶液中滴加少量___________作指示剂,再向其中滴加盐酸溶液至终点,消耗盐酸_________VmL;
③计算:纯碱样品纯度=__________________。
Ⅱ.某小组同学在0.1mol/LNaHCO3溶液中滴加酚酞溶液1滴,溶液没有什么变化,但加热后显淡红色,加热较长时间后冷却,红色不褪去。为探究原因,进行了下列实验:加热0.1mol/LNaHCO3溶液,测得溶液pH随温度变化的曲线:

当温度恢复到10℃,测得溶液 pH=11.5。
(5)依据图像信息对下列问题做出合理猜测:
①AB段pH上升原因:____________________________________________________,
②BC段pH上升原因:____________________________________________________;
(6)设计实验对BC段pH上升的合理猜测进行验证(药品任意选择):__________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com