
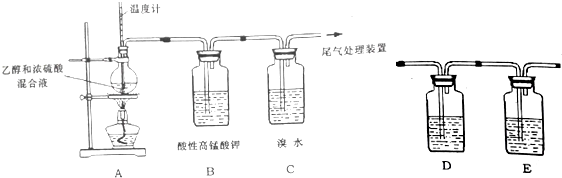
分析 (1)乙醇在浓硫酸作用下加热至170℃,发生消去反应生成乙烯;
(2)①乙烯含有碳碳双键具有强的还原性,被高锰酸钾氧化生成二氧化碳和水;
②制取的乙烯中含有二氧化硫,二氧化硫、乙烯都具有还原性,都能够使高锰酸钾褪色,检验乙烯应排除二氧化硫的干扰;
(3)溴水中存在Br2+H2O?HBr+HBrO,若发生加成反应,则消耗溴单质平衡逆向移动,溶液酸性减弱,若发生取代反应则生成强酸HBr,溶液酸式增强,据此解答;
(4)①依据浓硫酸在反应中起催化剂作用判断解答;
②A.反应焓变与反应物生成物状态有关,与催化剂无关;
B.依据催化剂对反应速率的影响;
C.使用催化剂能够降低反应的活化能;
D.平衡常数只与温度有关.
解答 解:(1)乙醇在浓硫酸作用下加热至170℃,发生消去反应生成乙烯,反应方程式:C2H5OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O;
故答案为:C2H5OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O;
(2)①乙烯含有碳碳双键具有强的还原性,被高锰酸钾氧化生成二氧化碳和水,化学方程式:5CH2=CH2+12MnO4-+36H+=12Mn2++10CO2↑+28H2O;
故答案为:5CH2=CH2+12MnO4-+36H+=12Mn2++10CO2↑+28H2O;
(3)②制取的乙烯中含有二氧化硫,二氧化硫、乙烯都具有还原性,都能够使高锰酸钾褪色,检验乙烯应排除二氧化硫的干扰,二氧化硫为酸性氧化物,能够被氢氧化钠溶液吸收,然后用品红溶液检验二氧化硫是否除尽,再通入酸性的高锰酸钾溶液,所以D中盛装的试剂是氢氧化钠,E中盛装的试剂是品红溶液;
故答案为:a;c;
(3)溴水中存在Br2+H2O?HBr+HBrO,若发生加成反应,则消耗溴单质平衡逆向移动,溶液酸性减弱,若发生取代反应则生成强酸HBr,溶液酸式增强,所以可以测定溴水反应前后后溶液pH变化:若PH值变大,则为加成反应,若PH值变小则为取代反应;
故答案为:测定反应前后溴水的PH值,若PH值变大,则为加成反应,若PH值变小则为取代反应;
(4)①浓硫酸在乙醇消去生成乙烯的反应中起催化剂作用,所以反应后生成产物为乙烯和硫酸,反应方程式:烯的生成:CH3CH2++HSO4-→CH2=CH2↑+H2SO4;
故答案为:CH3CH2+ HSO4- H2SO4;
②A.反应焓变与反应物生成物状态有关,与催化剂无关,所以使用浓硫酸不会改变反应焓变,故A错误;
B.催化剂能够加快反应速率,故B正确;
C.使用催化剂能够降低反应的活化能,使 更多分子变为活化分子,加快反应速率,故C正确;
D.平衡常数只与温度有关,温度不变,平衡常数不变,故D错误;
故选:BC
点评 本题以乙烯的实验室制备和性质检验载体考查了乙醇消去反应,明确反应原理及乙烯的性质是解题关键,注意催化剂对反应速率的影响,注意平衡常数只与温度有关,题目难度中等.


 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
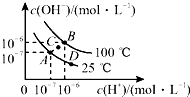
| A. | 图中A、B、D三点处Kw的大小关系:B>A>D | |
| B. | 若处在B点,将pH=2的硫酸与pH=10的KOH溶液等体积混合,溶液显中性 | |
| C. | 25℃时,保持温度不变,在水中加入适量NH4Cl固体,体系可从A点变化到C点 | |
| D. | A点所对应的溶液中,可同时大量存在Na+、Fe3+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 核裂变是一种化学变化 | |
| B. | 12753I的质量数为127,原子序数为53,核内有74个中子 | |
| C. | 碘12753I和放射性碘13153I属于同素异形体 | |
| D. | 12753I与13153I是同一种核素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 相关信息 |
| X | X的基态原子L层电子数是K层电子数的2倍 |
| Y | Y的基态原子最外层电子排布式为:nsnnpn+2 |
| Z | Z存在质量数为23,中子数为12的核素 |
| W | W有多种化合价,其白色氢氧化合物在空气中会迅速变成灰绿色,最后变成红褐色 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | 氢氧化钠溶液 | 混合溶液 | |
| 1 | 20.0 | 20.1 | 23.4 |
| 2 | 20.2 | 20.4 | 23.6 |
| 3 | 20.5 | 20.6 | 23.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com