
| ||
| ||
| 46×0.2g |
| 2 |
| 46 |
| 62 |
| 4.6g+2.3g |
| 23g/mol |
| 0.3mol×40g/mol |
| 7.7g+92.3g-0.2g |


 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:
| A、1mol的高锰酸钾参与反应有6mol电子发生转移 |
| B、高锰酸钾与双氧水都是常见氧化剂,高锰酸钾的氧化性比双氧水弱 |
| C、上反应中双氧水做还原剂 |
| D、在高锰酸钾溶液中加入足量含有双氧水的化妆品样品,溶液也不会褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
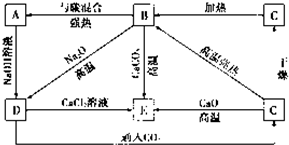 几种含硅元素的物质之间的相互转化关系如图所示.
几种含硅元素的物质之间的相互转化关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
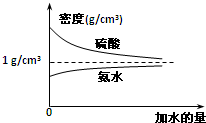 已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:
已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:| 溶液 | 溶质的物质的量浓度 | 溶液的密度/g?cm-3 |
| 硫酸 | 4mol?L-1 | ρ1 |
| 2mol?L-1 | ρ2 | |
| 氨水 | 4mol?L-1 | ρ3 |
| 2mol?L-1 | ρ4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
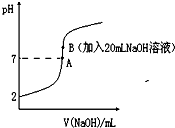 氢氟酸(HF)是一元弱酸,在水溶液中的电离方程式为:HF?H++F-.25℃下,向20mL0.2mol?L-1的氢氟酸中滴加0.2mol?L-1的NaOH溶液时,溶液的pH变化如图所示.
氢氟酸(HF)是一元弱酸,在水溶液中的电离方程式为:HF?H++F-.25℃下,向20mL0.2mol?L-1的氢氟酸中滴加0.2mol?L-1的NaOH溶液时,溶液的pH变化如图所示.| n(已电离的弱电解质) |
| n(全部的弱电解质) |
| c(H+)?c(F-) |
| c(HF) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com