
| A.第一电离能N>O | B.稳定性:H2O>HF |
| C.电负性:S>O | D.键角:H20>C2H2 |
科目:高中化学 来源: 题型:
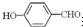
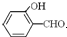
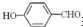 沸点比
沸点比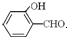 高,原因是
高,原因是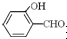 形成分子内氢键,而
形成分子内氢键,而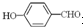 形成分子间氢键,分子间氢键使分子间作用力增大.
形成分子间氢键,分子间氢键使分子间作用力增大. 形成分子内氢键,而
形成分子内氢键,而 形成分子间氢键,分子间氢键使分子间作用力增大.
形成分子间氢键,分子间氢键使分子间作用力增大.| 224 |
| aNA |
| 224 |
| aNA |
查看答案和解析>>
科目:高中化学 来源:2011-2012学年江苏省射阳中学高二上学期期末考试化学(选修)试卷 题型:填空题
碳是形成化合物种类最多的元素,氮元素可以形成多种化合物,氧是地壳中含量最多的元素。
回答以下问题:(12分,每空2分)
(1)“低碳生活”倡导低能量、低消耗,主要是为了减少 (填化学式)的排放量.
(2)基态氮原子的价电子排布式是_________ ________。
(3)氧元素基态原子核外未成对电子数为 个。
(4)C、N、O三种元素第一电离能从大到小的顺序是____________。
(5)若某元素E的原子最外层电子排布为2s22 p1,某元素F的原子外围电子排布为2s22p2,则元素E与元素F的电负性从大到小顺序是_____ _______(用元素符号表示)。
元素F在元素周期表 区域(填s、p、d、ds、f区)
查看答案和解析>>
科目:高中化学 来源:2011年普通高等学校招生全国统一考试化学卷(山东) 题型:填空题
氧是地壳中含量最多的元素。
(1)氧元素基态原子核外未成对电子数为 个.
(2)H2O分子内的O-H键、分子间的范德华力和氢键从强到弱依次为 。
(3) H+可与H2O形成H3O+,H3O+中O原子采用 杂化。H3O+中H-O-H键角比H2O中H-O-H键角大,原因为 。
(4)CaO与NaCl的晶胞同为面心立方结构,已知CaO晶体密度为ag cm-3,
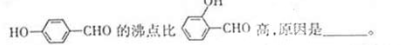
cm-3,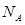 表示阿伏加德罗常数,则CaO晶胞体积为
Cm3。
表示阿伏加德罗常数,则CaO晶胞体积为
Cm3。
查看答案和解析>>
科目:高中化学 来源:山东 题型:问答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com