
有四种短周期元素 A、B、C、D,其中 A、B、C 在周期表中所处的位置如图所示,且它们的质子数之和为 32。D 元素原子的最外层电子数为次外层电子数的 2 倍。则下列说法正确的是( )
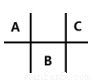
A.元素D形成的气态氢化物的空间结构一定是正四面体
B.A、B 两种元素的气态氢化物均能不它们的最高价氧化物对应的水化物发生反应,且反应类型相同
C.DB2 、DC4中每个原子都满足8电子稳定结构
D.四种元素形成的气态氢化物中,C元素形成的氢化物的稳定性最高
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2016届湖北省高三5月模拟三理综化学试卷(解析版) 题型:填空题
钛、铬、铁、镍、铜等金属及其化合物在工业上有重要用途。
(1)钛铁合金是钛系储氢合金的代表,该合金具有放氢温度低、价格适中等优点。
①Ti的基态原子价电子排布式为________________。
②Fe的基态原子共有________种不同能级的电子。
(2)制备CrO2Cl2的反应为K2Cr2O7+3CCl4===2KCl+2CrO2Cl2+3COCl2↑。
①上述化学方程式中非金属元素电负性由大到小的顺序是__________(用元素符号表示)。
②COCl2分子中所有原子均满足8电子构型,COCl2分子中σ键和π键的个数比为_____,中心原子的杂化方式为________。
(3)NiO、FeO的晶体结构均与氯化钠的晶体结构相同,其中Ni2+和Fe2+的离子半径分别为690pm和780pm。则熔点:NiO________(填“>”、“<”或“=”)FeO。
(4)Ni和La的合金是目前使用广泛的储氢材料,具有大容量、高寿命、耐低温等特点,在日本和中国已实现了产业化。该合金的晶胞结构如图所示。
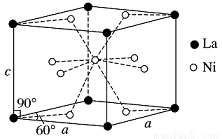
①该晶体的化学式为________________。
②已知该晶胞的摩尔质量为M g·mol-1,密度为d g·cm-3。设NA为阿伏加德罗常数的值,则该晶胞的体积是________ cm3(用含M、d、NA的代数式表示)。
③该晶体的内部具有空隙,且每个晶胞的空隙中储存6个氢原子比较稳定。已知:a=511 pm,c=397 pm;标准状况下氢气的密度为8.98×10-5 g·cm-3;储氢能力= 。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为_______。
。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为_______。
查看答案和解析>>
科目:高中化学 来源:2016届辽宁省高三全真模拟理综化学试卷(解析版) 题型:填空题
甲醇是重要的化工原料,又可称为燃料。工业上利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g) CH3OH(g) △H
CH3OH(g) △H
②CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H2=-58kJ•mol-1
CH3OH(g)+H2O(g) △H2=-58kJ•mol-1
③CO2(g)+H2(g) CO(g)+H2O(g) △H3=+41kJ•mol-1
CO(g)+H2O(g) △H3=+41kJ•mol-1
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:

则x=____________;
(2)若T℃时将6molCO2和8molH2充入2L密闭容器中发生反应②,测得H2的物质的量随时间变化关系如图中状态I(图中实线)所示。图中数据A(1,6)代表在1min时H2的物质的量是6mol。
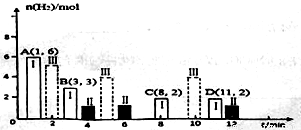
①T℃时状态I条件下,0~3min内CH3OH的平均反应速率v=_______mol/(L·min),平衡常数K=_____;
②其他条件不变时,仅改变某一条件后测得H2的物质的量随时间变化如图中状态Ⅱ所示,则改变的条件可能是_____;
③其他条件不变,仅改变温度时,测得H2的物质的量随时间变化如图中状态Ⅲ所示,则状态Ⅲ对应的温度_______(填“>”、“<”或“=”)T℃;
④若状态Ⅱ的平衡常数为K2,状态Ⅲ的平衡常数为K3,则K2_______(填“>”、“<”或“=”)K3;
⑤一定温度下同,此反应在恒容容器中进行,能判断该反应达到化学平衡依据的是_______。
a.容器中压强不变
b.甲醇和水蒸汽的体积比保持不变
c.v正(H2)=3v逆CH3OH)
d.2个C=O断裂的同时有6个H—H断裂
查看答案和解析>>
科目:高中化学 来源:2016届江西省高三考前热身理综化学试卷(解析版) 题型:选择题
核黄素又称维生素B2,可促进发育和细胞再生,有利于增进视力,减轻眼睛疲劳,核黄素分子的结构为:

已知: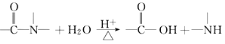
有关核黄素的下列说法中,不正确的是( )
A.该化合物的分子式为C17H22N4O6
B.酸性条件下加热水解,有CO2生成
C.酸性条件下加热水解,所得溶 液加碱后有NH3生成
D.能发生酯化反应
查看答案和解析>>
科目:高中化学 来源:2016届海南省高三考前模拟理综化学试卷(解析版) 题型:实验题
实验题:绿矾(FeSO4·7H2O)是治疗缺铁性贫血药品的重要成分。下列是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法。

已知:室温下饱和 H2S溶液的 pH 约为3.9,SnS沉淀完全时溶液的 pH 为1.6;FeS开始沉淀时溶液的 pH 为3.0,沉淀完全时的 pH 为5.5。
(1) 操作Ⅱ,在溶液中用硫酸酸化至 pH=2的目的是_______________________。
(2)操作Ⅳ的顺序依次为________、________、过滤、洗涤、干燥。
(3)操作Ⅳ得到的绿矾晶体用少量冰水洗涤,其目的是:
①除去晶体表面附着的硫酸等杂质;
②________________________________________________________________________。
(4)测定绿矾产品中Fe2+含量的方法是
a.称取一定质量的绿矾产品,配制成250.00 mL溶液;
b.量取25.00 mL 待测溶液于锥形瓶中;
c.用硫酸酸化的 0.010 00 mol·L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00 mL。
滴定时发生反应的离子方程式为5Fe2++MnO4-+8H+===5Fe3++Mn2++4H2O
①用硫酸酸化的 0.010 00 mol·L-1 KMnO4溶液滴定时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶中溶液颜色的变化判断此滴定实验达到终点的方法是___________________;
②若用上述方法测定的样品中FeSO4·7H2O的质量分数偏低(测定过程中产生的误差可忽略),其可能原因有___ _。
查看答案和解析>>
科目:高中化学 来源:2016届海南省高三考前模拟理综化学试卷(解析版) 题型:选择题
在下列叙述仪器“0”刻度位置正确的是( )
A.在量筒的上端
B.在滴定管上端
C.在托盘天平刻度尺的正中
D.在托盘天平刻度尺的右边
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省高二6月月考化学试卷(解析版) 题型:推断题
聚戊二酸丙二醇酯(PPG)是一种可降解的聚酯类高分子材料,在材枓的生物相存性方面有很好的应用前景. PPG的一种合成路线如下:

已知:
①烃A的相对分子质量为70,核磁共振氢谱显示只有一种化学环境的氢;
②化合物B为单氯代烃,化合物C的分子式为C5H8;
③E、F为相对分子质量差14的同系物,F是福尔马林的溶质;
④R1CHO+R2CH2CHO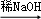
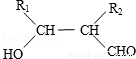
回答下列问题:
(1)A的结构简式为 .
(2)由B生成C的化学方程式为 .
(3)由E和F生成G的反应类型为 ,A的化学名称为 .
(4)①由D和H生成PPG的化学方程式为 .
②若PPG平均相对分子质量为10000,则其平均聚合度约为 (填标号).
a. 48 b. 58 c. 76 d.122
(5)D的同分异构体中能同时满足下列条件的共有 种(不含立体异构):
①能与饱和NaHCO3溶液反应产生气体
②既能发生银镜反应,又能发生皂化反应.其中核磁共振氢谱显示为3组峰,且峰面积比为6:1:1的是 (写构简式)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省高二6月月考化学试卷(解析版) 题型:选择题
某烷烃相对分子质量为86,如果分子中含有3个—CH3、2个—CH2—和1个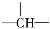 ,则该结构的烃的一氯取代物最多可能有几种(不考虑立体异构)
,则该结构的烃的一氯取代物最多可能有几种(不考虑立体异构)
A.9种 B.6种 C.5种 D.4种
查看答案和解析>>
科目:高中化学 来源:2015-2016学年内蒙古赤峰二中高二6月月考化学试卷(解析版) 题型:选择题
下列有关离子方程式书写或离子共存说法正确的是
A.在0.1 mol/L Na2CO3溶液中:Al3+、NH4+、SO42-、NO3-一定能大量共存
B.常温下,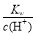 =0.1mol/L的溶液中,下列离子一定能大量共存:K+、Cl-、Fe2+、NO3-
=0.1mol/L的溶液中,下列离子一定能大量共存:K+、Cl-、Fe2+、NO3-
C.清洗锅炉时先用纯碱溶液浸泡的主要原因:CaSO4(s)+CO32-(aq) SO42-(aq)+CaCO3(s)
SO42-(aq)+CaCO3(s)
D.向Al2(SO4)3溶液中加入少量Ba(OH)2溶液:Ba2++SO42-+Al3++3OH-=BaSO4↓+Al(OH)3↓
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com