
【题目】298K、25℃,在NaHS溶液中,各离子的浓度随NaHS溶液浓度的变化关系如图所示,下列叙述不正确的是

已知:298K(25℃)H2S的Ka1=9.10×10-8,Ka2=1.10×10-12。
A.0.10mol/LNaHS溶液:c(Na+)>c(HS)>c(S2)>c(OH)>c(H+)
B.Na2S溶液中:c(Na+)=2c(S2)+2c(HS)+2c(H2S)
C.随着c(NaHS)浓度的增大c(H+)也将持续增大
D.当c(OH)=c(S2)时,c(H+)=10-9mol/L
 优等生题库系列答案
优等生题库系列答案科目:高中化学 来源: 题型:
【题目】甲同学采用如图Ⅰ所示装置验证铜与稀硝酸的反应,并用排水法收集NO气体。
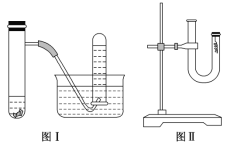
(1)反应过程中的实验现象是__________________________________________________。
(2)乙同学认为虽然收集到的气体为一氧化氮,但并不能说明反应中一定生成一氧化氮。你认为他的理由是______________________________________________________________。
(3)丙同学采用如图Ⅱ所示装置进行实验,证明了铜与稀硝酸反应生成一氧化氮。该同学的步骤如下表所示,请回答实验中的有关问题。
实验步骤 | 问题 |
①从U形管左端加入稀硝酸,直至充满U形管右端 | ______ |
②用附有铜丝的胶塞塞住U形管右端,观察现象 | 实验现象是______________ |
③待反应停止后打开胶塞,观察实验现象 | 打开胶塞后的实验现象是_______________________ |
(4)从环境保护的角度看,丙同学的实验存在__________缺陷?你认为应如何改进__________?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.2molNaOH和0.1molCa(OH)2的溶液中持续稳定地通入CO2气体,当通入气体为6.72L(标准状况)时立即停止,则这一过程中,溶液中离子数目和通入CO2气体的体积关系正确的图像是(气体的溶解忽略不计)
A.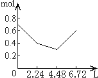 B.
B.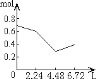
C.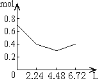 D.
D.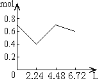
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用石墨电极完成下列电解实验
实验一 | 实验二 | |
装置 |
|
|
现象 | a、d处试纸变蓝;b处变红,局部褪色;c处无明显变化 | 两个石墨电极附近有气泡产生;n处有气泡产生…… |
下列对实验现象的解释或推测不合理的是( )
A. a、d处:2H2O+2e-=H2↑+2OH- B. b处:2Cl--2e-=Cl2↑
C. c处发生了反应:Fe-2e-=Fe2+ D. 根据实验一的原理,实验二中m处能析出铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用Al-PMOF可快速将芥子气降解为无毒物质,其结构如图。其中X、Y、Z为短周期元素且原子序数依次增大,X、Y同主族。下列说法正确的是
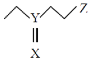
A.原子半径:Z>Y>X
B.YXZ2中Y的化合价为+5
C.含氧酸酸性:Z>Y
D.同浓度氢化物水溶液酸性:Z>Y>X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t℃时,Ag2CrO4(橘红色)在水中的沉淀溶解平衡平衡曲线如图所示。又知t℃时AgCl的Ksp=4×10-10,下列说法不正确的是( )
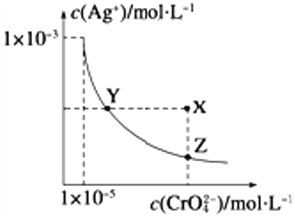
A. 在t℃时,Ag2CrO4的Ksp为1×10-8
B. 在饱和溶液中加入K2CrO4可使溶液由Y点到Z点
C. 在t℃时,Ag2CrO4(s)+2Cl-(aq)![]() 2AgCl(s)+CrO42-(aq)平衡常数K=6.25×107
2AgCl(s)+CrO42-(aq)平衡常数K=6.25×107
D. 在t℃时,以0.001mol/L AgNO3溶液滴定20mL 0.001mol/L KCl和0.001mol/L的K2CrO4的混合溶液,Cl-先沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧气、二氧化碳是最常见的气体。回答下列问题:
(1)宇航员呼吸产生的CO2用下列反应处理,实现空间站中的O2循环利用。镍催化剂反应:CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)
CH4(g)+2H2O(g)
①已知H2(g)+![]() O2(g)
O2(g)![]() H2O(g)ΔH=-akJ·mol-1,
H2O(g)ΔH=-akJ·mol-1,
CH4(g)+2O2(g)![]() CO2(g)+2H2O(g)ΔH=-bkJ·mol-1。则镍催化剂反应的ΔH=____kJ·mol-1
CO2(g)+2H2O(g)ΔH=-bkJ·mol-1。则镍催化剂反应的ΔH=____kJ·mol-1
②空间站中所涉及的反应有:
a.镍催化剂反应:CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)
CH4(g)+2H2O(g)
b.电解水反应:2H2O(l)=2H2(g)+O2(g)
c.模拟呼吸反应:C(s)+O2(g)=CO2(g)
则实现空间站O2循环总反应为____
(2)可用O2将HCl转化为Cl2,实现循环利用:O2(g)+4HCl(g)![]() 2Cl2(g)+2H2O(g)。将1molO2和4molHCl充入某恒容密闭容器中,分别在T1和T2的温度下进行实验,测得容器内总压强(p)与反应时间(t)的变化关系如图所示。
2Cl2(g)+2H2O(g)。将1molO2和4molHCl充入某恒容密闭容器中,分别在T1和T2的温度下进行实验,测得容器内总压强(p)与反应时间(t)的变化关系如图所示。

③该反应的速率v=kca(O2)·cb(HCl),k为速率常数),下列说法正确的是____(填标号)。
A.温度升高,k增大
B.使用催化剂,k不变
C.在容器中充入不反应的He,总压增大,k增大
D.平衡后再充入1molO2和4molHCl,k增大
④T1____T2(填“>”或“<”);T1时的转化率____T2时的转化率(填“>”“=”或“<”)。
⑤T1时,HCl的平衡转化率=____;T2反应的Kx=____(Kx为以物质的量分数表示的平衡常数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.1871 年门捷列夫最早预言了类硅元素锗,1886 年德国化学家温克勒发现和分离了锗元素,并以其祖国的名字命名为“Ge”。锗是重要的半导体材料,其有机化合物在治疗癌症方面有着独特的功效。下图为工业上利用锗锌矿(主要成分GeO2和ZnS)来制备高纯度锗的流程。
已知:
1.丹宁是一种有机沉淀剂,可与四价锗络合形成沉淀;
2.GeCl4易水解,在浓盐酸中溶解度低。
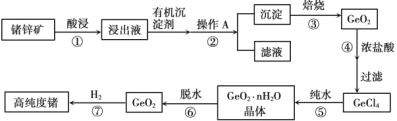
(1)锗元素在周期表中的位置:_____。
(2)步骤②操作A方法是_____。
(3)步骤③中的物质在_____(填仪器名称)中加热。
(4)步骤④不能用稀盐酸,原因可能是_____。
(5)写出步骤⑦的化学方程式_____。
Ⅱ.将过量的氨水加到硫酸铜溶液中,溶液最终变成深蓝色,继续加入乙醇,析出晶体Cu(NH3)4SO4·H2O。
(1)Cu2+基态核外电子排布式为 _________;1mol [Cu(NH3)4]2+中![]() 键的数目为_______。
键的数目为_______。
(2)SO42-的S原子轨道杂化类型_______________。
(3)NH3极易溶于H2O中,原因为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙是一种温和的氧化剂,常温下为白色的固体,无臭无味,能潮解,难溶于水,可与水缓慢反应;不溶于醇类、乙醚等,易与酸反应,常用作杀菌剂、防腐剂等。某实验小组拟选用如下装置(部分固定装置略)制备过氧化钙。
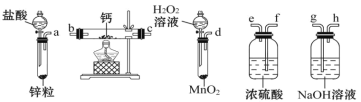
(1)请选择必要的装置,按气流方向连接顺序为_____(填仪器接口的字母编号,装置可重复使用)。
实验步骤如下:
①检验装置的气密性后,装入药品;
②打开分液漏斗活塞通入一段时间气体,加热药品;
③反应结束后,熄灭酒精灯,待反应管冷却至室温,停止通入氧气,并关闭分液漏斗的活塞;
④拆除装置,取出产物。
(2)一小组同学利用CaCl2在碱性条件下与H2O2反应制得。制备CaO2的实验方案和装置示意图如下:
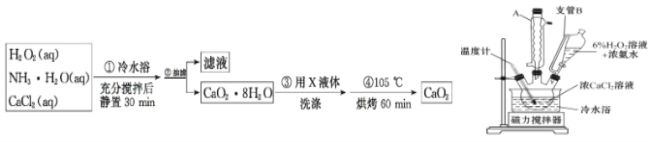
①三颈烧瓶中发生的主要反应的化学方程式为______________________________。
②支管B的作用是_____。
③步骤③中洗涤CaO2·8H2O的液体X 的最佳选择是_____;
A.无水乙醇 B.浓盐酸 C.水 D.CaCl2溶液
④该反应常用冰水浴控制温度在0℃左右,其可能的原因该反应是放热反应,温度低有利于提高CaO2·8H2O产率;_____。
(3)测定产品中CaO2 含量的实验步骤如下:
步骤一:准确称取a g 产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI 晶体,再滴入少量2 mol·L-1的硫酸,充分反应。
步骤二:向上述锥形瓶中加入几滴_____(作指示剂)。
步骤三:逐滴加入浓度为 c mol·L-1 的 Na2S2O3 溶液至反应完全,滴定至终点,记录数据,再重复上述操作2次,得出三次平均消耗Na2S2O3 溶液的体积为V mL。CaO2的质量分数为 _________(用字母表示)。(已知:I2+ 2S2O32-=2I-+ S4O62-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com