
| A、刚充入时反应速率v(正)增大,v(逆)增大 |
| B、达到新的平衡时,反应混合物中A、B的体积分数减小 |
| C、充入A、B、Q后,体系压强先增大,后逐渐减小 |
| D、若B为有色物质,达到新平衡后混合气颜色比原平衡浅 |


科目:高中化学 来源: 题型:
| A、2d | B、2.5d |
| C、5d | D、10d |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氧化铝的熔点很高,所以不可以用来冶炼铝 |
| B、氢氧化铝可以和悬浮于水中的泥沙形成絮状不溶物沉降下来,使水澄清,所以明矾可用作净水剂 |
| C、实验室可以用过量氢氧化钠与氯化铝来制备氢氧化铝 |
| D、氢氧化铝既可与酸反应又可与碱反应,是两性氢氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
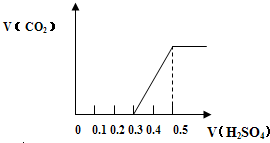 分别称取质量为m1g的NaHCO3和NaOH的固体混合物样品两份,置于密闭容器中,在300℃条件下充分加热,排尽气体后,测得剩余固体质量为 m2g.小林和小芳两同学对加热后的剩余固体进行研究.为研究方便,令a=
分别称取质量为m1g的NaHCO3和NaOH的固体混合物样品两份,置于密闭容器中,在300℃条件下充分加热,排尽气体后,测得剩余固体质量为 m2g.小林和小芳两同学对加热后的剩余固体进行研究.为研究方便,令a=| m2 |
| m1 |
| 53 |
| 79 |
| 53 |
| 61 |
查看答案和解析>>
科目:高中化学 来源: 题型:
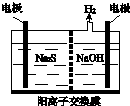 Ⅰ硫化氢的转化是资源利用和环境保护的重要研究课题.由硫化氢获得硫单质有多种方法.
Ⅰ硫化氢的转化是资源利用和环境保护的重要研究课题.由硫化氢获得硫单质有多种方法.查看答案和解析>>
科目:高中化学 来源: 题型:
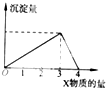 将X气体(或溶液)慢慢通入(或加人)一定量的Y溶液中,产生沉淀量与加入X的物质的量(mol)的关系如图所示,符合如图情况的是( )
将X气体(或溶液)慢慢通入(或加人)一定量的Y溶液中,产生沉淀量与加入X的物质的量(mol)的关系如图所示,符合如图情况的是( )| A、X为NaOH溶液,Y为AlCl3溶液 |
| B、X为CO2,Y为Ca(OH)2溶液 |
| C、X为NH3,Y为AlCl3溶液 |
| D、X为HCl溶液,Y为Na[Al(OH)4]溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com