(1)20g A物质和14g B物质完全反应,生成8.8g C物质、3.6g D物质和0.2mol E物质,则E物质的摩尔质量为______.
(2)12.4g Na2X含有0.4mol Na+,Na2X的摩尔质量为______,该物质的化学式为______.
解:(1)化学反应遵循质量守恒定律,有m(A)+m(B)=m(C)+m(D)+m(E),则m(E)=20g+14g-8.8g-3.6g=21.6g,所以M(E)=
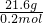
=108g/mol,故答案为:108g/mol;
(2)Na
2X中含有0.4mol Na
+,Na
2X的物质的量为0.2mol,则Na
2X的摩尔质量=

=
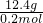
=62g/mol,摩尔质量在数值上等于其相对分子质量,钠原子的相对原子质量是23,所以X的相对原子质量是62-23×2=16,X为氧原子,该物质的化学式为Na
2O,故答案为:62g/mol;Na
2O.
分析:(1)根据质量守恒可计算E的物质的量,结合M=

计算摩尔质量;
(2)根据n=

来计算,摩尔质量在数值上等于其相对原子质量,根据相对原子质量来确定分子式;
点评:本题主要考查物质的量的计算,题目难度不大,注意质量守恒定律、摩尔质量在数值上等于其相对分子质量等概念的运用.

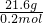 =108g/mol,故答案为:108g/mol;
=108g/mol,故答案为:108g/mol; =
=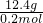 =62g/mol,摩尔质量在数值上等于其相对分子质量,钠原子的相对原子质量是23,所以X的相对原子质量是62-23×2=16,X为氧原子,该物质的化学式为Na2O,故答案为:62g/mol;Na2O.
=62g/mol,摩尔质量在数值上等于其相对分子质量,钠原子的相对原子质量是23,所以X的相对原子质量是62-23×2=16,X为氧原子,该物质的化学式为Na2O,故答案为:62g/mol;Na2O. 计算摩尔质量;
计算摩尔质量; 来计算,摩尔质量在数值上等于其相对原子质量,根据相对原子质量来确定分子式;
来计算,摩尔质量在数值上等于其相对原子质量,根据相对原子质量来确定分子式;
