
分析 (1)在金属活动性顺序表中,位于H之前的金属,可以从稀硫酸中置换出氢气,较为活泼的金属可以置换较不活泼的金属;
(2)根据反应物、生成物、反应条件写出反应方程式.
解答 解:(1)A应水排在金属活动性顺序表中H之前的金属,才能从硫酸中置换出氢气,较为活泼的金属可以置换不活泼的金属,比如铁与硫酸铜反应置换出Cu,故答案为:排在H之前的金属;盐;
(2)电解饱和食盐水的反应物是氯化钠和水,产物是氢氧化钠和氯气、氢气,反应条件是电解,故答案为:2 NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$ 2NaOH+Cl2↑+H2↑
实验室制取氯气的反应物是二氧化锰和浓盐酸,产物是氯化锰和氯气、水,条件是加热,该反应中二氧化锰作氧化剂,浓盐酸是还原剂,
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;加热\;}}{\;}$MnCl2+Cl2↑+2H2O
点评 本题主要考查的是金属活动性顺序表的应用以及化学反应方程式得到书写,难度不大.


 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:解答题
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
| 离子 | Fe 2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
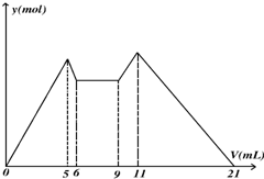
| A. | 原混合液中,c(Al3+):c(Mg2+):c(Cl-)=1:1:5 | |
| B. | A是NaOH,B是盐酸,且c(NaOH):c(HCl)=2:1 | |
| C. | 若A,B均为一元强酸或者一元强碱,则V(A):V(B)=7:13 | |
| D. | 从6到9,相应离子反应式H++OH-═H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+(aq)+OH-(aq)═H2O(l)△H=+57.3kJ•mol-1 | |
| B. | 加入少量蒸馏水,平衡①和②均向右移动 | |
| C. | 溶液中c(CH3COOH)>c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 加入少量CaCl2溶液,所得溶液中:c(CH3COOH)+2c(OH-)=c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 铅蓄电池的工作原理为Pb+PbO2+4H++2SO${\;}_{4}^{2-}$$?_{充电}^{放电}$2PbSO4+2H2O.下图所示装置中,A为PbO2电极,B为Pb电极,E、F均为PbSO4电极,U形管中盛有足量硫酸溶液.先闭合S1足够长时间后断开S1,下列有关说法中不正确的是( )
铅蓄电池的工作原理为Pb+PbO2+4H++2SO${\;}_{4}^{2-}$$?_{充电}^{放电}$2PbSO4+2H2O.下图所示装置中,A为PbO2电极,B为Pb电极,E、F均为PbSO4电极,U形管中盛有足量硫酸溶液.先闭合S1足够长时间后断开S1,下列有关说法中不正确的是( )| A. | 闭合S1时,左侧U形管为原电池,右侧U形管为电解池,F电极上生成氧气 | |
| B. | 若将两U形管中的溶液混合,混合液的质量分数仍为30% | |
| C. | 若再单独闭合S2,电极A、B的质量会逐渐增加,电极E、F的质量会逐渐减小 | |
| D. | 若再单独闭合S2,E、F电极上发生的反应与之前相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 都属于氧化还原反应 | B. | 发生还原反应的元素相同 | ||
| C. | 发生氧化反应的元素不同 | D. | 生成KCl的物质的量为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化铁 FeO 碱性氧化物 | B. | 碳酸气 CO 酸性氧化物 | ||
| C. | 硫酸 H2S 酸 | D. | 纯碱 Na2CO3 盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业和民用上大量燃烧含硫的化石燃料 | |
| B. | 森林遭到乱砍滥伐,破坏了生态平衡 | |
| C. | 汽车排出大量含碳氧化物的尾气 | |
| D. | 人口膨胀,生活中二氧化碳排放量增加 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com