
| A. | 由溴丙烷水解制丙醇;由丙烯与氯气在加热(500℃)反应制得一氯丙烯 | |
| B. | 由甲苯硝化制对硝基甲苯:由甲苯氧化制苯甲酸 | |
| C. | 由氯代环己烷消去制环己烯:由丙烯加溴制1,2-二溴丙烷 | |
| D. | 由乙酸和乙醇制乙酸乙酯:由苯甲酸乙酯水解制苯甲酸和乙醇 |
分析 A.溴丙烷水解制丙醇,发生取代反应,丙烯与氯气发生取代反应生成一氯丙烯;
B.甲苯硝化制对硝基甲苯发生取代反应,甲苯发生氧化反应生成苯甲酸;
C.氯代环己烷消去制环己烯,为消去反应,丙烯发生加成反应生成1,2-二溴丙烷;
D.酯化反应和酯类的水解都为取代反应.
解答 解:A.溴丙烷水解制丙醇,发生取代反应,丙烯与氯气发生取代反应生成一氯丙烯,都属于加成反应,反应类型相同,故A正确;
B.甲苯硝化制对硝基甲苯发生取代反应,甲苯发生氧化反应生成苯甲酸,分别属于取代反应和氧化反应,故B错误;
C.氯代环己烷消去制环己烯,为消去反应,丙烯发生加成反应生成1,2-二溴丙烷,分别属于消去反应、加成反应,故C错误;
D.由乙酸和乙醇制乙酸乙酯为取代反应:由苯甲酸乙酯水解制苯甲酸和乙醇,为取代反应,反应类型相同,故D正确.
故选AD.
点评 本题考查有机物的结构与性质,为高频考点,把握有机物中的官能团及官能团与性质的关系为解答的关键,侧重性质及有机反应类型的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 标况下,11.2L CO和N2混合气体中含有的原子数是NA | |
| B. | 100g 98%的浓硫酸中,氧原子总数为4NA | |
| C. | 1 mol•L-1的NaClO溶液中含有ClO-的数目小于NA | |
| D. | 1 mol SO2与足量O2在一定条件下反应生成SO3,共转移2NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2+Br2+H2O═H2SO4+2HBr | B. | SO2+H2O═H2SO3 | ||
| C. | SO2+2NaOH═Na2SO3+H2O | D. | SO2+CaO$\frac{\underline{\;高温\;}}{\;}$CaSO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
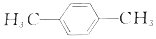 )与对苯二甲醛(
)与对苯二甲醛(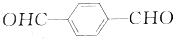 )均可被氧气直接氧化为对苯二甲酸,前后两种方案中,制备等量的对苯二甲酸时.理论上消耗的氧气物质的量之比为( )
)均可被氧气直接氧化为对苯二甲酸,前后两种方案中,制备等量的对苯二甲酸时.理论上消耗的氧气物质的量之比为( )| A. | 3:1 | B. | 2:1 | C. | 1:1 | D. | 4:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌为正极 | B. | 电子从锌极流出 | ||
| C. | 锌极发生氧化反应 | D. | 电解液肯定不是强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
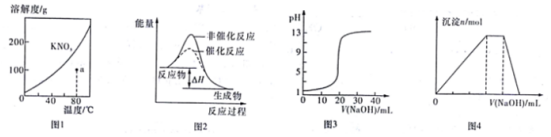
| A. | 图1表示KNO3的溶液曲线,图中a点所示的溶液是80℃时KNO3的不饱和溶液 | |
| B. | 图2表示某放热反应分别有无催化剂的情况下反应过程中的能量变化 | |
| C. | 图3表示0.1000mol•L-1醋酸溶液得到的滴定曲线 | |
| D. | 图4表示向NH4Al(SO4)2溶液中逐滴滴加NaOH溶液,随着NaOH溶液体积V的变化,沉淀总物质的量n的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol/L 的硫酸铵溶液中:c(NH4+)>c(SO42?)>c(H+)>c(OH?) | |
| B. | 0.2mol/LNaHCO3溶液与0.1mol/LNaOH溶液等体积混合:c(H+)═c(OH?)+c(HCO3?)+2c(H2CO3) | |
| C. | pH之和为14的H2C2O4与KOH 溶液混合:c(K+)>c(H+)>c(OH?)>c(HC2O4?) | |
| D. | pH=5 的H2S溶液中,c(H+)>c(HS?)=1×10-5mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com