
·ÖĪö £Ø1£©·ÖĪö·“Ó¦ÖŠø÷ŌŖĖŲ»ÆŗĻ¼Ū±ä»Æ£¬ŅĄ¾ŻŃõ»Æ»¹Ō·“Ó¦µĆŹ§µē×ÓŹŲŗć£¬Ō×ÓøöŹżŹŲŗćÅäĘ½·½³ĢŹ½£¬²¢ÓĆĖ«ĻßĒűķŹ¾£»
£Ø2£©·“Ó¦ĪļÖŠĖłŗ¬ŌŖĖŲ»ÆŗĻ¼ŪÉżøßµÄĪŖ»¹Ō¼Į£¬¶ŌÓ¦Ńõ»Æ²śĪļ£¬Ėłŗ¬ŌŖĖŲ»ÆŗĻ¼Ū½µµĶµÄ ·“Ó¦ĪļĪŖŃõ»Æ¼Į£¬¶ŌÓ¦»¹Ō²śĪļ£»
£Ø3£©·“Ó¦ÖŠĀČŌŖĖŲ»ÆŗĻ¼ŪÓÉ-1¼ŪÉżøßĪŖ0¼Ū£¬ĮīÉś³ÉµÄĀČĘųµÄĪļÖŹµÄĮæĪŖxmol£¬øł¾Żµē×Ó×ŖŅĘĮŠ³ö¼ĘĖćxµÄÖµ£¬²¢øł¾Ż·½³ĢŹ½·ÖĪö±»Ńõ»ÆµÄCl-µÄøöŹżĪŖŹż£®
½ā“š ½ā£ŗ£Ø1£©K2Cr2O7+HCl£ØÅØ£©=KCl+CrCl3+Cl2”ü+H2O£¬K2Cr2O7ÖŠ+6¼ŪCr»ÆŗĻ¼Ū½µĪŖCrCl3ÖŠ+3¼Ū£¬·“Ó¦1molK2Cr2O7£¬µĆµ½6molµē×Ó£¬HClÖŠ-1¼ŪµÄCl»ÆŗĻ¼ŪÉżøßĪŖCl2ÖŠµÄ0¼Ū£¬Éś³É1molCl2Ź§Č„2molµē×Ó£¬ŅĄ¾ŻµĆŹ§µē×ÓŹŲŗćæÉÖŖ£ŗCrCl3ĻµŹżĪŖ2£¬Cl2ĻµŹżĪŖ3£¬Č»ŗóøł¾Ż·“Ó¦Ē°ŗóø÷ÖÖŌ×ÓøöŹżĻąµČÅäĘ½µĆ£ŗK2Cr2O7+14HCl£ØÅØ£©=2KCl+2CrCl3+3Cl2”ü+7H2O£¬¹ŹĻµŹżĪŖ£ŗ1£¬14£¬2£¬2£¬3£¬7£»ÓĆĖ«ĻßĒűķŹ¾ĪŖ£ŗ £»
£»
¹Ź“š°øĪŖ£ŗ1£¬14£¬2£¬2£¬3£¬7£» £»
£»
£Ø2£©·“Ó¦ÖŠK2Cr2O7ÖŠ+6¼ŪCr»ÆŗĻ¼Ū½µĪŖCrCl3ÖŠ+3¼Ū£¬ĖłŅŌK2Cr2O7ĪŖŃõ»Æ¼Į£¬CrCl3ĪŖ»¹Ō²śĪļ£»HClÖŠ-1¼ŪµÄCl»ÆŗĻ¼ŪÉżøßĪŖCl2ÖŠµÄ0¼Ū£¬ĖłŅŌHClĪŖ»¹Ō¼Į£¬Cl2ĪŖŃõ»Æ²śĪļ£¬¹Ź“š°øĪŖ£ŗK2Cr2O7£»Cl2£»
£Ø3£©n£Øe-£©=$\frac{6.02”Į1{0}^{23}}{6.02”Į1{0}^{23}}$=1mol
K2Cr2O7+14HCl£ØÅØ£©=2KCl+2CrCl3+3Cl2”ü+7H2O”«6mole-
14 3 6
$\frac{7}{3}$ x 1
$\frac{3}{x}$=$\frac{6}{1}$½āµĆx=0.5£¬v£ØCl2£©=0.5”Į22.4=11.2L£¬14HCl£ØÅØ£©ÖŠÓŠ6HCl£ØÅØ£©£¬¼ŪĢ¬·¢Éś±ä»Æ£¬¹ŹÓŠ6Cl-±»Ńõ»Æ£¬
n£ØCl-£©=$\frac{7}{3}”Į\frac{6}{14}$=1mol£¬N£ØCl-£©=1”ĮNA=6.02”Į1023£¬
¹Ź“š°øĪŖ£ŗ11.2L£»6.02”Į1023£®
µćĘĄ ±¾Ģāæ¼²éŃõ»Æ»¹Ō·“Ó¦ÖŖŹ¶£¬ĢāÄæÄŃ¶Č²»“ó£¬×¢Ņā°ŃĪÕŌŖĖŲ»ÆŗĻ¼ŪµÄÉż½µµÄÅŠ¶Ļ£¬øł¾ŻŌŖĖŲ»ÆŗĻ¼ŪµÄ±ä»ÆÅŠ¶ĻµĆŹ§µē×ӵďżÄ森


 ŠĒ¼¶æŚĖćĢģĢģĮ·ĻµĮŠ“š°ø
ŠĒ¼¶æŚĖćĢģĢģĮ·ĻµĮŠ“š°ø Ć¢¹ū½ĢøØ“ļ±ź²āŹŌ¾ķĻµĮŠ“š°ø
Ć¢¹ū½ĢøØ“ļ±ź²āŹŌ¾ķĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
| »Æѧ·“Ó¦ | Ę½ŗā³£Źż | ĪĀ¶Č£Ø”ę£© | |
| 500 | 800 | ||
| ¢Ł2H2£Øg£©+CO£Øg£©?CH3OH£Øg£© | K1 | 2.5 | 0.15 |
| ¢ŚH2£Øg£©+CO2£Øg£©?H2O £Øg£©+CO£Øg£© | K2 | 1.0 | 2.50 |
| ¢Ū3H2£Øg£©+CO2£Øg£©?CH3OH£Øg£©+H2O £Øg£© | K3 | ||
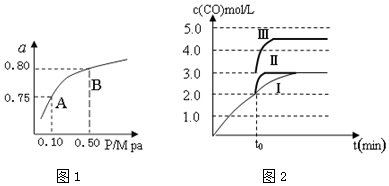
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
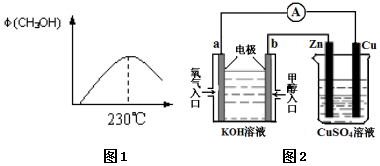 ÄÜŌ“ĪŹĢāŹĒČĖĄąÉē»įĆęĮŁµÄÖŲ“óæĪĢā£¬¼×“¼ŹĒĪ“Ą“ÖŲŅŖµÄÄÜŌ“ĪļÖŹÖ®Ņ»£®
ÄÜŌ“ĪŹĢāŹĒČĖĄąÉē»įĆęĮŁµÄÖŲ“óæĪĢā£¬¼×“¼ŹĒĪ“Ą“ÖŲŅŖµÄÄÜŌ“ĪļÖŹÖ®Ņ»£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ¹ĢĢå·Ö½āŌ½ĶźČ«£¬ĻūŗÄŃĪĖįµÄĮæŌ½ÉŁ | |
| B£® | ¹²Éś³É0.1mol¶žŃõ»ÆĢ¼£¬¹ĢĢåÖŠĀČ»ÆÄĘĪŖ5.85g | |
| C£® | ¹ĢĢåÖŠĢ¼ĖįĒāÄĘŗ¬ĮæŌ½¶ą£¬ÄĘŌŖĖŲµÄŗ¬ĮæŅ²Ō½¶ą | |
| D£® | ČÜŅŗÖŠµÄÄĘĄė×ÓĪŖ0.11mol£¬Ō¹ĢĢåÖŠµÄĢ¼ĖįĒāÄĘĪŖ8.4g |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¼ĘĖćĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¶ąŃ”Ģā
| A£® | Ńõ»Æ·“Ó¦ | B£® | Č”“ś·“Ó¦ | C£® | ¼Ó³É·“Ó¦ | D£® | ĻūČ„·“Ó¦ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
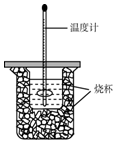 ÓĆ50mL0.50mol/LŃĪĖįÓė50mL0.55mol/LNaOHČÜŅŗŌŚČēĶ¼ĖłŹ¾µÄ×°ÖĆÖŠ½ųŠŠÖŠŗĶ·“Ó¦£®Ķعż²ā¶Ø·“Ó¦¹ż³ĢÖŠĖł·Å³öČČĮææɼĘĖćÖŠŗĶČČ£®»Ų“šĻĀĮŠĪŹĢā£ŗ
ÓĆ50mL0.50mol/LŃĪĖįÓė50mL0.55mol/LNaOHČÜŅŗŌŚČēĶ¼ĖłŹ¾µÄ×°ÖĆÖŠ½ųŠŠÖŠŗĶ·“Ó¦£®Ķعż²ā¶Ø·“Ó¦¹ż³ĢÖŠĖł·Å³öČČĮææɼĘĖćÖŠŗĶČČ£®»Ų“šĻĀĮŠĪŹĢā£ŗ²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
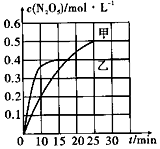 ½üČÕ£¬Īķö²ÓÖÉĻĮĖ¶ČÄļČČĖŃ°ń£®ĘäÖ÷ŅŖ³É·Ö°üĄØ»Ņ³¾”¢SO2”¢NOx”¢ÓŠ»śĢ¼Ēā»ÆŗĻĪļµČĮ£×Ó£®ŃĢĘųĶŃĻõŹĒÖĪĄķĪķö²µÄ·½·ØÖ®Ņ»£®
½üČÕ£¬Īķö²ÓÖÉĻĮĖ¶ČÄļČČĖŃ°ń£®ĘäÖ÷ŅŖ³É·Ö°üĄØ»Ņ³¾”¢SO2”¢NOx”¢ÓŠ»śĢ¼Ēā»ÆŗĻĪļµČĮ£×Ó£®ŃĢĘųĶŃĻõŹĒÖĪĄķĪķö²µÄ·½·ØÖ®Ņ»£®| ČŻĘ÷ | ¼× | ŅŅ |
| ČŻ»ż/L | 1 | 1 |
| ĪĀ¶Č/K | T1 | T2 |
| ĘšŹ¼³äČėĮæ | lmolO32mol NO2 | lmolO3 2mol NO2 |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com