
| t/min | 0 | 3 | 10 | 12 |
| n(CO)/mol | 2 | 1 | 0.5 | 0.5 |
| n(CH3OH)/mol | 0 | 1 | 1.5 | 1.5 |
| A. | 在0~3min内,用H2表示的平均反应速率为0.33mol•L-1•min-1 | |
| B. | 在该条件下,上述反应的平衡常数为3 | |
| C. | 反应达平衡时,CH3OH (g)的体积分数为50% | |
| D. | 要增大反应速率且增大 CH3OH (g)在混合物中的体积分数,可采用压缩体积,增大体系压强的措施 |
分析 由表格中数据可知,
CO(g)+2H2(g)?CH3OH(g)
开始 4 0
转化 1.5 3 1.5
平衡 0.5 1 1.5
A.结合v=$\frac{△c}{△t}$计算;
B.K为生成物浓度幂之积与反应物浓度幂之积的比;
C.转化率=$\frac{转化的量}{开始的量}$×100%;
D.增大压强反应速率加快,平衡向体积减小的方向移动.
解答 解:A.在0~3min内,由甲醇的量可知,用H2表示的平均反应速率为$\frac{\frac{1mol}{2L}}{3min}$×2=0.33mol•L-1•min-1,故A正确;
B.在该条件下,上述反应的平衡常数K=$\frac{(\frac{1.5mol}{2L})}{(\frac{0.5mol}{2L})×(\frac{1mol}{2L})^{2}}$=12,故B错误;
C.反应达平衡时,CH3OH (g)的体积分数为$\frac{1.5}{0.5+1+1.5}$×100%=50%,故C正确;
D.该反应为气体体积减小的反应,采用压缩体积,增大体系压强的措施,增大反应速率,平衡正向移动,且增大 CH3OH (g)在混合物中的体积分数,故D正确;
故选B.
点评 本题考查化学平衡的计算,为高频考点,把握表格中数据、平衡三段法、K及速率的计算为解答的关键,侧重分析与计算能力的考查,注意选项B为易错点,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | c(A2-)>c(H2A) | B. | c(Na+)+c(H+)=c(OH-)+c(HA-)+2c(A2-) | ||
| C. | c(Na+)=c( HA-)+c(H2A) | D. | c(H+)=c(A2-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 现象 | 结论 |
| A | 用pH试纸测定等浓度的HCl、H2SO4两溶液的pH | 测定HCl溶液的pH试纸更红 | 非金属性Cl>S |
| B | 将AgCl和AgBr的饱和溶液等体积混合 | 出现淡黄色沉淀 | Ksp(AgBr)<Ksp(AgCl) |
| C | 向Al2(SO4)3溶液中滴加过量氢氧化钡溶液 | 生成白色沉淀 | A l(OH)3 不溶于氢氧化钡溶液 |
| D | 将Fe(NO3)2 样品溶于稀硫酸,滴加KSCN溶液 | 溶液变红 | Fe(NO3)3 样品溶于稀硫酸前已氧化变质 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
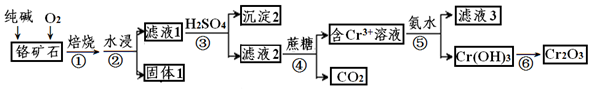
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
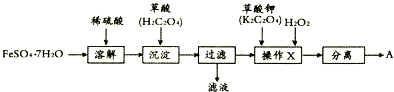
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
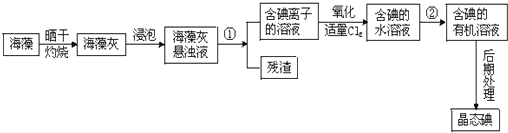
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的标准燃烧热为△H=-890.3 kJ/mol,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3 kJ/mol | |
| B. | 已知H2O(l)=H2O(g)△H=+44 kJ/mol,则2gH2(g)完全燃烧生成液态水比生成气态水多释放22kJ的热量 | |
| C. | 硝酸铵溶于水温度降低,这个过程发生的是吸热反应 | |
| D. | 同温同压下,H2(g)+Cl2(g)=2HCl(g),在光照和点燃条件下△H的相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
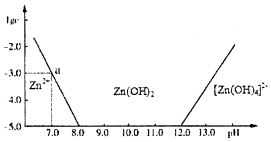 锌和铝都是活泼金属,它们的单质及化合物的性质具有一定的相似性.
锌和铝都是活泼金属,它们的单质及化合物的性质具有一定的相似性.| C(HCl)/(mol•L-1) | 0.50 | 1.00 | 2.04 | 2.90 | 4.02 | 5.16 | 5.78 |
| C(PbCl2)/(mol•L-1)×10-3 | 5.10 | 4.91 | 5.21 | 5.90 | 7.48 | 10.81 | 14.01 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com