
| A. | 该物质与足量的H2加成后,只能生成一种物质 | |
| B. | 该物质既是CH2═CH2的同系物,又是CH≡CH的同系物 | |
| C. | 该物质既能使酸性KMnO4溶液褪色,又能使溴水褪色 | |
| D. | 该物质经加成,加聚后产物是氯丁橡胶(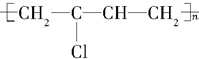 )的主要成分 )的主要成分 |
科目:高中化学 来源: 题型:选择题
| A. | 元素的最高正价数一定等于其原子核外最外层电子数 | |
| B. | 原子序数为79的元素在第六周期第IB族 | |
| C. | 碱金属单质的熔、沸点从上到下递减 | |
| D. | 同周期从左到右,元素的金属性递减,非金属性递增 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
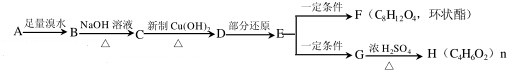
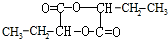 ,H
,H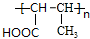 .
.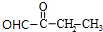 +2Cu(OH)2$\stackrel{△}{→}$
+2Cu(OH)2$\stackrel{△}{→}$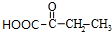 +Cu2O+2H2O,E→F2
+Cu2O+2H2O,E→F2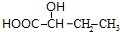 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +2H2O.
+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属性:P>S>Cl | B. | 碱性:NaOH>KOH>RbOH | ||
| C. | 气态氢化物稳定性:HF>HCl>HBr | D. | 酸性:H2SO4>HClO4>HBrO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 全部 | B. | ②③④⑤⑥⑦ | C. | ②③④⑤⑦ | D. | 只有③④⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
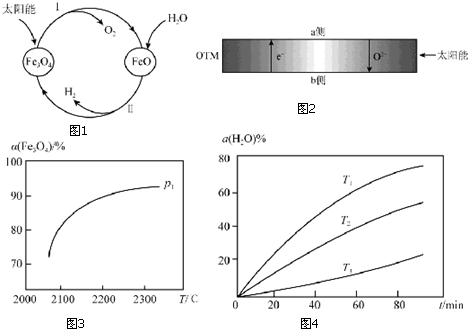
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com