
| A. | ① | B. | ② | C. | ①③ | D. | ②③ |
分析 100mL 2mol/L AlCl3溶液中n(AlCl3)=0.1L×2mol/L=0.2mol,若只发生反应:AlCl3+3NaOH=Al(OH)3↓+3NaCl,生成氢氧化铝为0.2mol,其质量=0.2mol×78g/mol=15.6g>7.8g,说明有两种情况:一为沉淀不完全,只生成Al(OH)3沉淀;另一种情况为铝离子完全沉淀后部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2,根据方程式计算.
解答 解:100mL 2mol/L AlCl3溶液中n(AlCl3)=0.1L×2mol/L=0.2mol,若只发生反应:AlCl3+3NaOH=Al(OH)3↓+3NaCl,生成氢氧化铝为0.2mol,其质量=0.2mol×78g/mol=15.6g>7.8g,说明有两种情况:一为沉淀不完全,只生成Al(OH)3沉淀;另一种情况为铝离子完全沉淀后部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2.
①若碱不足,只发生Al3++3OH-═Al(OH)3↓,可知NaOH的物质的量为$\frac{7.8g}{78g/mol}$×3=0.3mol,
加入NaOH溶液的体积为$\frac{0.3mol}{4mol/L}$=0.075L=75mL;
②沉淀部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2,则:
Al3++3OH-═Al(OH)3↓
0.2mol 0.6mol 0.2mol
则溶解的氢氧化铝为0.2mol-$\frac{7.8g}{78g/mol}$=0.1mol,
Al(OH)3+OH-═AlO2-+2H2O
0.1mol 0.1mol
则消耗的碱的物质的量为0.6mol+0.1mol=0.7mol,加入NaOH溶液的体积为$\frac{0.7mol}{4mol/L}$=0.175L=175mL;
故选:C.
点评 本题考查过量问题的计算,属于讨论型计算,题目难度中等,判断可能发生的反应是解题关键.


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:解答题
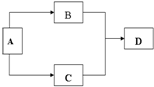 由主族元素组成的A、B、C、D四种常见物质,有如图所示转换关系(部分反应物、生成物没有列出).且四种物质均含有同一种元素.
由主族元素组成的A、B、C、D四种常见物质,有如图所示转换关系(部分反应物、生成物没有列出).且四种物质均含有同一种元素.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱金属中Li的还原性最强 | B. | 碱金属阳离子,氧化性最强的是Li+ | ||
| C. | 和Li同一主族的都是金属元素 | D. | Li在空气中加热生成过氧化锂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常温下,浓度均为0.10mol/L、体积均为V0的HA和HB溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示,下列叙述正确的是( )
常温下,浓度均为0.10mol/L、体积均为V0的HA和HB溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示,下列叙述正确的是( )| A. | 该温度下HB的电离平衡常数约等于1.11×10-5 | |
| B. | 当lg$\frac{V}{{V}_{0}}$=3时,若两溶液同时升高温度,则$\frac{c({B}^{-})}{c({A}^{-})}$减小 | |
| C. | 相同条件下NaA溶液的pH大于NaB溶液的pH | |
| D. | 溶液中水的电离程度:a=c>b |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
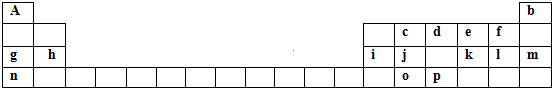
 ,画出k元素的离子结构示意图
,画出k元素的离子结构示意图
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
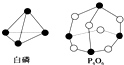 化学反应可视为旧键断裂和新键形成的过程.化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量.已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能(kJ/mol):P-P:198,P-O:360,O=O:498,对于反应P4(白磷)+3O2=P4O6,当2mol,白磷与氧气充分反应的能量变化为( )
化学反应可视为旧键断裂和新键形成的过程.化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量.已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能(kJ/mol):P-P:198,P-O:360,O=O:498,对于反应P4(白磷)+3O2=P4O6,当2mol,白磷与氧气充分反应的能量变化为( )| A. | 放热1638 kJ | B. | 吸热1638 kJ | C. | 吸热3276 kJ | D. | 放热3276 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验目的 | 实验步骤 | |
| A | 检验久置的Na2SO3粉末是否变质 | 取样配成溶液,加入盐酸酸化,再加BaCl2溶液,观察是否生成沉淀 |
| B | 检验碘盐中是否含有碘元素 | 取样配成溶液,加入淀粉溶液,观察溶液是否变蓝 |
| C | 检验碳单质与浓硫酸反应的产物 | 将反应生成的气体通过无水硫酸铜粉末、澄清石灰水、品红溶液 |
| D | 探究铁与水在高温下发生反应 | 将水蒸气通过灼热的铁粉看粉末是否变红 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com