
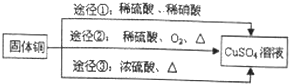
 ,其中还原剂是Cu.上述途径中你认为最佳途径是②,选择的理由是原料利用率高,环境污染小.
,其中还原剂是Cu.上述途径中你认为最佳途径是②,选择的理由是原料利用率高,环境污染小. 分析 (1)依据C=$\frac{1000ρω}{M}$计算浓硫酸的物质的量浓度;
(2)①依据溶液稀释规律计算需要浓硫酸体积,依据浓硫酸体积选择合适规格的量筒;
②依据配制一定物质的量浓度溶液的一般步骤选择需要仪器;
③分析操作对溶质的物质的量和溶液的体积影响,依据C=$\frac{n}{V}$进行误差分析;
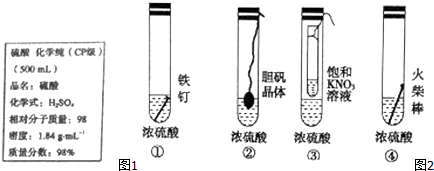
(3)①浓硫酸具有强的氧化性,常温下生铁钝化;
②浓硫酸具有吸水性,能够吸收晶体中结晶水;
③浓硫酸具有吸水性,饱和硝酸钾溶液中容积减少,有晶体析出;
④浓硫酸具有脱水性,能够使木棒碳化;
(4)铜与浓硫酸在加热条件下反应生成硫酸铜、二氧化硫和水,依据元素化合价升降判断氧化剂和还原剂,用双线桥表示;
金属铜可以和硝酸之间反应生成硝酸铜、一氧化氮和水,但是一氧化氮是有毒的,根据铜、稀硫酸的性质来判断反应的发生;
解答 解:(1)浓硫酸的物质的量浓度C=$\frac{1000×1.84×98%}{98}$=18.4mol/L;
故答案为:18.4mol•L-1;
(2)①设需要浓硫酸体积V,依据溶液稀释过程中所含溶质的物质的量不变得:18.4mol/L×V=0.4mol•L-1×250mL,解得V=5.4mL;
②配制一定物质的量浓度溶液的一般步骤:计算、量取、稀释、移液、洗涤、定容,用到的仪器:量筒、烧杯、玻璃棒、250mL容量瓶、胶头滴管,所以还缺少的仪器:胶头滴管、烧杯;
③a.容量瓶水洗后未干燥,对溶质的物质的量和溶液体积都不产生影响,溶液浓度不变,故a不选;
b.向容量瓶中转移时,有少量液体溅出,导致溶质的物质的量偏小,溶液浓度偏低,故b选;
c.定容时俯视刻度线,导致溶液体积偏小,溶液浓度偏高,故c不选;
故选:c;
故答案为:①5.4; ②胶头滴管、烧杯;③b;
(3)①浓硫酸具有强的氧化性,常温下生铁钝化,不能证明浓硫酸具有吸水性,故不选;
②浓硫酸具有吸水性,能够吸收胆矾晶体中结晶水使其变为白色硫酸铜,能证明浓硫酸具有吸水性,故选;
③浓硫酸具有吸水性,饱和硝酸钾溶液中容积减少,有晶体析出,能证明浓硫酸具有吸水性,故选;
④浓硫酸具有脱水性,能够使木棒碳化,不能证明浓硫酸具有吸水性,故不选;
故选:②③;
(4)在Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O反应中,Cu元素化合价升高,失电子被氧化,铜做还原剂,S元素化合价降低,得电子被还原,H2SO4是氧化剂;铜失电子数=1(2-0)=2,硫酸得电子数=1(6-4)=2,该反应中转移电子数是2,用用双线桥标出该反应电子转移的方向和数目为: ;
;
金属铜可以和硝酸之间反应生成硝酸铜、一氧化氮和水,即3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O,铜不能和稀硫酸反应,但是当加热并通入空气之后,铜和氧气反应生成氧化铜,然后氧化铜会和硫酸反应生成硫酸铜,不会产生污染大气的气体,该过程原料利用率高,环境污染小,所以途径②最佳,
故答案为: ;②;原料利用率高,环境污染小.
;②;原料利用率高,环境污染小.
点评 本题为综合题,考查了一定物质的量浓度溶液的配制,浓硫酸性质实验设计,明确配制过程及操作步骤及浓硫酸的性质是解题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
 氮可以形成多种化合物,如NH3、N2H4、HCN、NH4NO3等.
氮可以形成多种化合物,如NH3、N2H4、HCN、NH4NO3等.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极.通电一段时间后,在c、d两极上共收集到 336mL (标准状态)气体.回答:
如图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极.通电一段时间后,在c、d两极上共收集到 336mL (标准状态)气体.回答:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3加在BaCl2前 | B. | Na2CO3加在BaCl2后 | ||
| C. | 同时加 | D. | 无固定顺序 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属腐蚀就是金属原子失去电子被还原的过程 | |
| B. | 钢铁吸氧腐蚀时,负极反应式为2H2O+O2+4e-═4OH- | |
| C. | 向醋酸钠溶液中加入适量醋酸至混合液pH=7时,溶液中c(Na+)=c(CH3COO-) | |
| D. | 0.1 mol/L NH4Cl溶液中,c(NH${\;}_{4}^{+}$)+c(H+)=c(Cl-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com