
| ||
| ||
| ||


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、麦芽糖及其水解产物均能发生银镜反应 |
| B、用溴水即可鉴别苯酚溶液、2,4-己二烯和甲苯 |
| C、在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH |
D、用甘氨酸(H2N-CH2-COOH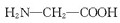 )和丙氨酸( )和丙氨酸(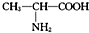 )缩合最多可形成4种二肽 )缩合最多可形成4种二肽 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na产生的多 |
| B、Mg产生的多 |
| C、Al产生的多 |
| D、一样多 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、△H>0表示放热反应,△H<0 表示吸热反应 |
| B、若反应△H>0;△S<0,则反应一定能自发进行 |
| C、1 mol H2与0.5 mol O2反应放出的热就是H2的燃烧热 |
| D、热化学方程式中的化学计量数表示物质的量,所以可以是分数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯气溶于水:Cl2+H2O═2H++Cl-+ClO- |
| B、氯化铝溶液中加入过量氨水:Al3++4NH3?H2O═AlO2-+4NH4++2H2O |
| C、过量二氧化硫通入氢氧化钠溶液中:SO2+OH-═SO32-+H2O |
| D、氢氧化铝与足量盐酸反应,Al(OH)3+3H+═Al3++3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| A、1mol CH3OH(g)完全燃烧放出的热量大于192.9 kJ | ||
B、根据反应①和②推知反应:H2(g)+
| ||
| C、CH3OH转变成H2的过程不一定要吸收能量 | ||
D、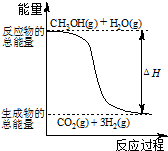 反应①中的能量变化如图所示 |
查看答案和解析>>
科目:高中化学 来源: 题型:
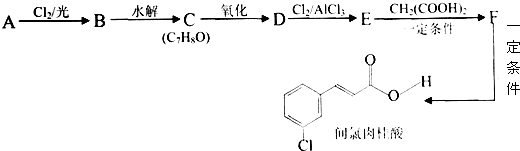
| 一定条件 |
| 一定条件 |
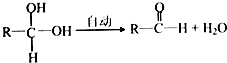
| Cl2/光 |
| 水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
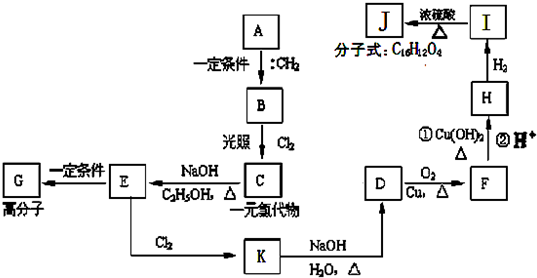
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间(s) n(mol) | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com