
| Q |
| n |
| 100×4.18×3.3×10-3 |
| 0.03 |
| 100×4.18×3.3×10-3 |
| 0.03 |


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH相同的①CH3COONa、②NaHCO3、③Na2CO3三份溶液中的c(Na+):③>②>① |
| B、0.1mol?L-1某二元弱酸强碱盐NaHA溶液中:c(Na+)=2c(A2-)+c(HA-)+c(H2A) |
C、如图中pH=7时:c(Na+)>c(CH3COO-)>c(OH-)=c(H+) |
D、如图中a点溶液中各离子浓度的关系是:c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | 固体混合物 | 除杂方法或除杂试剂 |
| ① | Na2CO3(NaHCO3) | |
| ② | Fe2O3(Al2O3) |
查看答案和解析>>
科目:高中化学 来源: 题型:
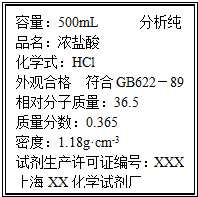 取质量为14.8g的Na2CO3和NaHCO3的固体混合物,与100mL 2.50mol?L-1的盐酸恰好完全反应不再放出气体.
取质量为14.8g的Na2CO3和NaHCO3的固体混合物,与100mL 2.50mol?L-1的盐酸恰好完全反应不再放出气体.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cl-、ClO-、Fe2+、K+ |
| B、NH4+、SO42-、K+、Cl- |
| C、MnO4-、Cl-、Na+、K+ |
| D、HCO3-、SO42-、K+、Mg2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铁与稀硫酸反应:Fe+6H+=2Fe3++3H2↑ |
| B、用稀盐酸除铁锈:Fe2O3+6H+=2Fe3++3H2O |
| C、碳酸钙与稀盐酸反应:CaCO3+2H+=Ca2++H2O+CO2↑ |
| D、氢氧化钡溶液与硫酸溶液反应:Ba2++OH-+H++SO42-=BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、单质铜与稀硝酸反应3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O |
| B、钠与水的反应Na+2H2O=Na++2OH-+H2↑ |
| C、氯气溶于水Cl2+H2O=2H++ClO-+Cl- |
| D、碳酸氢钠跟盐酸反应CO32-+2H+=H2O+CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 不同压强下的转化率/% | |||
| 0.1MPa | 0.5MPa | 1MPa | 10MPa | |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com