
【题目】某学生用 NaOH 标准溶液滴定未知浓度的盐酸,进行了如下实验:
取 15.00mL 待测溶液于 250mL 锥形瓶中,加入 1~2 滴酚酞试液,用 NaOH 标准溶液滴定。按上述操作方 法再重复 2 次。
(1)填空:(①、②小题中选填“偏高”、“偏低”或“无影响”)
①装碱滴定管用蒸馏水洗涤后,直接加入 NaOH 标准溶液进行滴定,则待测液的浓度_____;
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去 NaOH 标准溶液的体积_____;
③滴定时边滴边摇动锥形瓶,眼睛应观察_____;
④滴定达到终点时,酚酞指示剂由_____色变成_____色。
(2)滴定结果如下表所示:

若 NaOH 标准溶液的浓度为 0.1010mol/L,则待测液的浓度为_____。
【答案】偏高 无影响 锥形瓶内溶液颜色的变化 无 浅红 0.1347mol/L
【解析】
(1)根据c(待测)=c(标准)×V(标准)/V(待测)分析不当操作对相关物理量的影响,以此判断浓度的误差.
①根据滴定管没有润洗,导致待装液浓度减小分析;
②根据锥形瓶中有水,不影响待测液的物质的量分析;
③酸碱中和滴定时,眼睛要注视锥形瓶内溶液的颜色变化;
④根据反应结束前,溶液为无色,反应结束后滴入氢氧化钠溶液,溶液显示红色分析;
(2)计算出两次滴定消耗标准液体积的平均值,然后根据中和反应实质计算出该盐酸的浓度.
(1)①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,导致标准液的浓度减小,滴定时消耗的标准液的体积增大,c(待测)=c(标准)×V(标准)/V(待测),则HCl溶液浓度偏高;
②锥形瓶用蒸馏水洗涤后,水未倒尽,对待测液氯化氢的物质的量没有影响,则滴定时用去NaOH标准溶液的体积无影响,对结果没有影响;
③酸碱中和滴定时,眼睛要注视锥形瓶内溶液的颜色变化,以便及时判断滴定终点;
④待测液是盐酸,标准液是氢氧化钠溶液,待测液中加入酚酞无色,滴入氢氧化钠溶液随中和反应进行到最后一滴溶液从无色变为红色,且半分钟不褪色;
(2)依据图表数据分析可知,两次实验中消耗氢氧化钠溶液体积分别为:21.10ml-1.05ml=20.05ml、21.95ml-2.00ml=19.95ml,氢氧化钠溶液的平均体积为(20.05+19.95)/2ml=20.00ml,由酸碱中和反应可知,氢离子物质的量=氢氧化钠物质的量,则该待测液的浓度为C=0.1010mol·L-1×20mL/15mL≈0.1347mol·L-1。


科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,请回答有关问题:
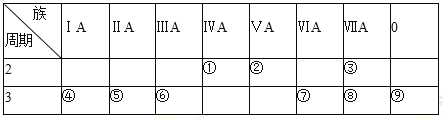
(1)①的元素符号为 _________;⑨的原子结构示意图为 _________。
(2)第3周期主族元素中,原子半径最小的是_________(用元素符号表示)。
(3)表中元素的气态氢化物中最稳定的是_____________________(用化学式表示)。
(4)①、②、⑦、⑧四种元素的最高价氧化物的水化物中酸性最强的是_________(用化学式表示)。
(5)⑤、⑥两种元素相比较,金属性较强的是_________(填元素名称),可以验证这一结论的实验是_________(填正确选项的编号)。
A.将在空气中放置已久的这两种元素的块状单质分別放入NaOH溶液中,比较反应的剧烈程度
B.将形状、大小相同的这两种元素的单质分别和同浓度的盐酸反应,比较反应的剧烈程度
C.将形状,大小相同的这两种元素的单质分别和热水作用,并滴入酚酞试液,比较反应的剧烈程度
(6)④和⑥两种元素的最高价氧化物的水化物在水溶液中反应的离子方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(12分) 某实验小组用下图装置进行乙醇催化氧化的实验。Z.X.X.K]
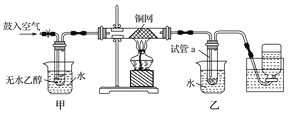
(1)实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学反应方程式 。
在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该乙醇氧化反应是 反应(放热或吸热)。
(2)甲和乙两个水浴作用不相同。甲的作用是 ;
乙的作用是 。
(3)反应进行一段时间后,干燥试管a中能收集到不同的物质,它们是 ,
集气瓶中收集到的气体的主要成分是 。
(4)若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有 。要除去该物质,可先在混合液中加入 (填写字母)。然后,再通过 (填实验操作名称)即可除去。
a.氯化钠溶液 b.苯 c.碳酸氢钠溶液 d.四氯化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定体积CaCl2和HCl的混合溶液中逐滴加入浓度为1 mol·L-1的Na2CO3溶液,反应过程中加入的Na2CO3溶液的体积与产生沉淀或气体的质量关系如图所示。
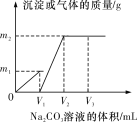
已知图中V1∶V2=1∶2;当加入V2 mL Na2CO3溶液时,所得溶液的浓度为1 mol·L-1,体积为200 mL。求:
(1)加入V2 mL Na2CO3溶液时,所得溶液的溶质是________。
(2)原混合溶液中CaCl2和HCl的物质的量之比n(CaCl2)∶n(HCl)=________。
(3)m1=________g,m2=________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,下列说法中正确的是( )
A.0.1mol/L Na2SO4溶于水中,所得溶液中Na+个数为0.2NA
B.78g Na2O2中含有离子总数为3NA
C.标准状况下,NA个水分子所占的体积为22.4L
D.Na2O2与CO2反应生成2.24L氧气转移电子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国某科研团队设计了一种新型能量存储/转化装置(如图所示)。闭合K2、断开K1时,制氢并储能;断开K2、闭合K1时,供电。下列说法错误的是( )

A.制氢时,溶液中K+向Pt电极移动
B.供电时,Zn电极附近溶液的pH不变
C.供电时,X电极发生还原反应
D.制氢时,X电极反应式为Ni(OH)2-e-+OH-=NiOOH+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,根据所给的10种元素,完成以下各小题。
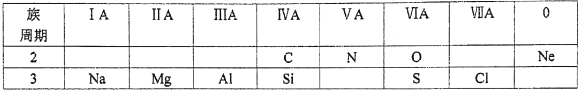
(1)镁的原子结构示意图为____。
(2)H2SO4与HClO4中,酸性较强的是____。
(3)NaOH与Al (OH)3中,属于两性氢氧化物的是____。它常用作治疗胃酸(含盐酸)过多的药物,该反应的离子方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L密闭容器中进行如下反应:N2+3H2![]() 2NH3,5min内氨的物质的量增加了0.1mol,则反应速率为
2NH3,5min内氨的物质的量增加了0.1mol,则反应速率为
A.v(H2)=0.02 mol/(L·min)
B.v(N2)=0.01 mol/(L·min)
C.v(NH3)=0.01 mol/(L·min)
D.v(N2)=0.03 mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学通过对比实验了解Na2CO3和NaHCO3性质的异同,下表是他们撰写的实验报告的一部分。
① | 在贴有标签a、b的试管中分别加入1.0g Na2CO3固体和NaHCO3固体,观察外观。 | / |
② | 继续向两试管中分别加入10.0mL水,用力振荡,观察现象。 | / |
③ | 再分别向两试管中滴加2滴酚酞溶液,观察现象。 | 溶液均变红,颜色较深的试管是 (填 “a”或“b”)。 |
④ | 最后分别向两溶液中滴加足量盐酸。 | 红色褪去,均有无色气体产生.经计算生成气体的是a b(填“>”“<”或“=”)。 |
⑤ | 加热大试管一段时间。(注:棉花球沾有无水硫酸铜粉末)
| / |
(1)请帮助该小组同学完成实验报告中放入内容_____________。
(2)已知:20℃时Na2CO3的溶解度为20.5g。由实验_______(填实验序号)现象可知,20℃时NaHCO3的溶解度小于20.5g;如果向饱和Na2CO3溶液中不断通入CO2气体,现象是________,化学方程式是_________。
(3)由实验⑤可以得出结论是_______,用化学方程式说明得出结论的原因______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com