

 .
. .
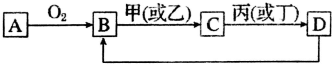
.分析 甲、乙、丙为三种金属单质;A、C、D常温下为气体,其中C呈黄绿色判断为Cl2;G为白色沉淀;H为红褐色沉淀判断为Fe(OH)3;G为Fe(OH)2,B溶液焰色反应显黄色说明含有钠元素,金属甲和水反应生成气体A和碱B,金属乙和碱反应证明为Al,所以B为NaOH,甲为Na,A为H2,乙为Al,D为HCl,E为盐酸溶液,依据G的成分可知F一定含铁元素,因此丙为Fe,金属铁和盐酸溶液反应生成F为FeCl2,依据判断出的物质分析回答问题.
解答 解:甲、乙、丙为三种金属单质;A、C、D常温下为气体,其中C呈黄绿色判断为Cl2;G为白色沉淀;H为红褐色沉淀判断为Fe(OH)3;G为Fe(OH)2,B溶液焰色反应显黄色说明含有钠元素,金属甲和水反应生成气体A和碱B,金属乙和碱反应证明为Al,所以B为NaOH,甲为Na,A为H2,D为HCl,E为盐酸溶液,依据G的成分可知F一定含铁元素,因此丙为Fe,金属铁和盐酸溶液反应生成F为FeCl2;
(1)已知甲原子的质量数为23,甲为Na,原子的质子数为11,依据质子数+中子数=质量数;则原子核内的中子数为12;
故答案为:12;
(2)乙元素为铝元素,原子的结构示意图为: ,故答案为:
,故答案为: ;
;
(3)上述推断可知,F为氯化亚铁的化学式为:FeCl2;
故答案为:FeCl2;
(4)B为NaOH与乙为Al反应生成A为H2,反应的离子反应方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(5)反应①是钠和水反应生成氢氧化钠和氢气的反应,反应的化学方程式为:2Na+2H2O=2NaOH+H2↑,反应②为Fe(OH)2,被空气中的氧气氧化成氧化铁,反应的化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:2Na+2H2O=2NaOH+H2↑;4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(6)D为HCl属于共价化合物,氢原子最外层电子与Cl最外层电子形成一对共用电子对,其形成过程可写为: ,
,
故答案为: ;
;
(7)单质磷在C中燃烧,是磷在氯气中燃烧,生成的产物中各原子的最外层均达到8电子稳定结构,该化合物为PCl3,
故答案为:PCl3;
(8)甲、乙、C常见简单离子为Na+、Al3+、Cl-,氯离子有三个电子层半径最大,钠离子和铝离子电子层数相同,核电荷数越大半径越小,则半径大小为:Cl->Na+>Al3+,
故答案为:Cl->Na+>Al3+;
点评 本题考查了物质转化关系的分析应用,物质性质的综合应用,主要是质量数计算应用,原子结构示意图、电子式等,反应条件、反应现象和物质的物理性质是判断的依据,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 水蒸气通过炽热的铁,生成Fe2O3和H2 | |
| B. | 用湿润的淀粉碘化钾试纸检验某气体,试纸变蓝,该气体一定是Cl2 | |
| C. | 除去NO中混有的少量NO2,可将混合气体通过盛有水的洗气瓶,再用排空气法收集NO | |
| D. | 反应MnO2+ZnS+2H2SO4═MnSO4+ZnSO4+S+2H2O中,每析出12.8 g S共转移0.8mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.4mol•L-1 | B. | 0.6mol•L-1 | C. | 0.8mol•L-1 | D. | 1.1mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeO溶于稀硝酸:FeO+2H+═Fe2++H2O | |
| B. | Al2(SO4)3溶液中加入过量Ba(OH)2溶液:Al3++4OH-═AlO2-+2H2O | |
| C. | 漂白粉溶液中通入少量CO2:2ClO-+H2O+CO2═2HClO+CO32- | |
| D. | 等物质的量的NO和NO2同时被NaOH溶液吸收:NO+NO2+2OH-═2NO2-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 13C表示核内有6个质子,核外有7个电子的一种核素 | |
| B. | 氧气O2和臭氧O3互为同素异形体 | |
| C. | CH3OCH3和CH3CH2OH是互为同分异构体 | |
| D. | 磁性纳米材料是直径为1~100nm(1nm=10-9m)的磁性粒子分散在基础物质中所形成的具有胶体性质的一种材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
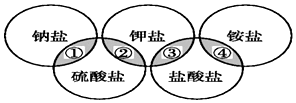 下列各项中的物质,能满足如图中阴影部分关系的是( )
下列各项中的物质,能满足如图中阴影部分关系的是( )| ① | ② | ③ | ④ | |
| A | NaCl | K2SO4 | KCl | (NH4)2SO4 |
| B | NaCl | K2SO4 | KCl | NH4Cl |
| C | Na2SO4 | K2SO4 | KCl | NH4Cl |
| D | Na2SO4 | K2SO4 | KCl | (NH4)2SO4 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com