
 正在研制的一种“高容量、低成本”锂-铜空气燃料电池,该电池通过一种复杂的铜腐蚀现象产生电力,其中放电过程2Li+Cu2O+H2O=2Cu+2Li++2OH-,下列说法不正确的是( )
正在研制的一种“高容量、低成本”锂-铜空气燃料电池,该电池通过一种复杂的铜腐蚀现象产生电力,其中放电过程2Li+Cu2O+H2O=2Cu+2Li++2OH-,下列说法不正确的是( )| A. | 放电一段时间后右侧睡溶液pH升高 | |
| B. | 整个反应过程中,铜相当于催化剂 | |
| C. | 通空气时,铜被腐蚀,表面产生CuO | |
| D. | 放电时,正极的电极反应式为 Cu2O+H2O+2e-=Cu+2OH- |
分析 放电时,锂失电子作负极,Cu上O2得电子作正极,负极上电极反应式为Li-e-═Li+,正极上电极反应式为Cu2O+H2O+2e-=2Cu+2OH-,电解质溶液中阳离子向正极移动,阴离子向负极移动,据此分析解答.
解答 解:A.放电时,正极上电极反应式为Cu2O+H2O+2e-=2Cu+2OH-,所以放电一段时间后右侧溶液pH升高,故A正确;
B.通空气时,铜被腐蚀,表面产生Cu2O,放电时Cu2O转化为Cu,则整个反应过程中,铜相当于催化剂,故B正确;
C.放电过程为2Li+Cu2O+H2O═2Cu+2Li++2OH-,正极上Cu2O反应,碱性条件下通空气时,铜被氧化表面产生Cu2O,故C错误;
D.正极发生还原反应,正极的电极反应式为Cu2O+H2O+2e-=2Cu+2OH-,故D正确;
故选C.
点评 本题考查了原电池原理,明确原电池负极上得失电子及电极反应式是解本题关键,题目难度中等,注意把握Cu在整个过程中的作用.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
 某学习小组用下列实验方案来制备乙酸乙酯,装置(夹持装置省略)如图.
某学习小组用下列实验方案来制备乙酸乙酯,装置(夹持装置省略)如图.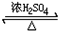 CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.| 密度/(g•cm-3) | 沸点/℃ | |
| 乙酸 | 1.05 | 118.1 |
| 乙醇 | 0.780 | 78.3 |
| 乙酸乙酯 | 0.905 | 77.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 葡萄糖和果糖分子式均为C6H12O6,均属于还原糖 | |
| B. | 淀粉和纤维素都属于多糖,其中每个葡萄糖单元包含三个羟基 | |
| C. | 糖类并不是都有甜味,有甜味的物质也不一定是糖类 | |
| D. | 葡萄糖具有多羟基醛的结构,属于最简单的单糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 糖类化合物都具有相同的官能团 | |
| B. | 用核磁共振氢谱不能区分HCOOCH3和HCOOCH2CH3 | |
| C. | 乙醛和丙烯醛( )不是同系物,它们与氢气充分反应后的产物是同系物 )不是同系物,它们与氢气充分反应后的产物是同系物 | |
| D. | 磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将pH=4的某酸稀释10倍,测得其pH<5,则该酸为弱酸 | |
| B. | 相同pH 的 CH3COONa、NaOH 和Na2CO3三种溶液:c(NaOH)<c(Na2CO3)<c(CH3COONa) | |
| C. | 0.1mol/LNaHA 溶液 pH=5,则溶液:c(HA-)>c(H+)>c(A2-)>c(H2A) | |
| D. | 已知H2CO3的电离常数K1=4.4×10-7、K2=4.7×10-11,HClO的电离常数K=2.9×10-8,若向新制氯水中加入足量Na2CO3固体,则c(HClO)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X与水反应形成的二元酸的分子式是H2CO3 | |
| B. | Y是一种非极性分子,能与水反应生成强酸 | |
| C. | Y+A→X+Z的化学方程式为2 P+5SO3=5SO2+P2O5 | |
| D. | Z在加热时与水反应的产物名称是磷酸 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省徐州市高二上第一次月考化学试卷(解析版) 题型:填空题
(1)铝热反应是铝的一个重要性质,该性质用途十分广泛,不仅被用于焊接钢轨,而且还常被用于冶炼高熔点的金属如钒、铬、锰等。
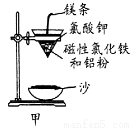
①某校化学兴趣小组同学,取磁性氧化铁按教材中的实验装置(如图甲)进行铝热反应,现象很壮观。取反应后的“铁块”溶于盐酸,向其中滴加KSCN溶液,发现溶液变血红色。出现这种现象的原因,除了可能混有没反应完的磁性氧化铁外,还有一个原因是 ;
②若证明上述所得“铁块”中含有金属铝,可选择 (填试剂名称),所发生反应的离子方程式为 ;
(2)现有FeCl3、AlCl3的混合溶液100mL,逐滴加入NaOH溶液,生成沉淀的物质的量随加入的NaOH的物质的量的关系如图,
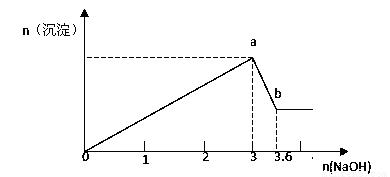
请计算出①a处沉淀的总物质的量 mol;
②c(FeCl3)= mol/L;③c(AlCl3)= mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 风力、化石燃料、水能都是一次能源 | |
| B. | 开发氢能、太阳能、风能、生物质能等新型能源是践行低碳生活的有效途径 | |
| C. | 电能是现代社会中应用最广泛、使用最方便、污染最小的一种二次能源 | |
| D. | 用脱硫处理的煤代替原煤作燃料可以有效减少空气中CO2气体的含量 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省高一上第一次月考化学试卷(解析版) 题型:计算题
常温下,将20.0 g质量分数为14.0%的KNO3溶液与30.0 g质量分数为24.0%的KNO3溶液混合,得到的密度为1.15 g/cm3的混合溶液。计算:
(1)混合后溶液的质量分数。
(2)混合后溶液的物质的量浓度。
(3)在1 000 g水中需溶解多少摩尔KNO3才能使其浓度恰好与上述混合后溶液的浓度相等?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com