
【题目】I.2016年,我国研制的大型运输机运-20正式进入投产,标志着我国成为少数几个能生产大型军用运输机的国家之一。
(1)运-20的外壳大量使用了AM系列Mg-Al-Mn,铝的价电子排布图为_____,第一电离能铝___________(填“大于”、“等于”或“小于”)镁
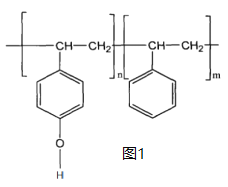
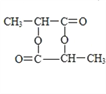
(2)为了减轻飞机的起飞重量并保持机身强度,运-20使用了大量的树脂材料,其中一种树脂材料的部分结构如图1所示,其中碳原子的杂化方式为___________,其个数比为___________
II.大型飞机的高推重比发动机被誉为航空工业皇冠上的“宝石”,采用大量的金属钨作为耐高温耐磨损材料
(3)钨元素位于第六周期第VIB族,价电子排布的能级与Cr相同,但排布方式与Cr有所不同,请写出钨原子的价层电子排布式___________
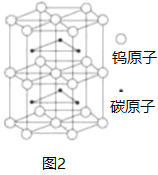
(4)图2为碳和钨形成的一种化合物的晶胞模型,碳原子和钨原子个数比为___________,其中一个钨原子周围距离最近且相等的碳原子有___________个。下列金属的堆积方式与晶胞中钨原子堆积方式完全相同的是___________
A.Fe Cu B.Ti Ag C.Cu Au D.Zn Mg
【答案】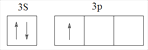 小于 sp2 sp3 3:1 5d46s2 1:1 6 D
小于 sp2 sp3 3:1 5d46s2 1:1 6 D
【解析】
(1)铝是13号元素,最外层有三个电子,根据核外电子排布规律,铝的价电子排布图为 ;镁、铝属于同一周期元素,镁元素的最外层电子排布为3s2,处于全充满状态,相对比较稳定,所以第一电离能:铝小于镁;
;镁、铝属于同一周期元素,镁元素的最外层电子排布为3s2,处于全充满状态,相对比较稳定,所以第一电离能:铝小于镁;
(2)根据树脂的结构简式可知,分子中碳元素部分形成苯环,杂化轨道类型为sp2,部分全部以单键形式连接,杂化轨道类型为sp3,对应个数比为12:4=3:1;
(3)钨元素位于周期表的第六周期第VIB族,其价层电子排布式为5d46s2;
(4)在此结构中钨原子数目为1+2×1/2+12×1/6+6×1/3=6,碳原子个数为6,因此碳原子和钨原子个数比为1:1;根据中心钨原子可知,1个钨原子周围距离钨原子最近的碳原子有6个,碳化钨晶胞中碳原子和钨原子所处位置为六方最密堆积,与Mg、Zn的堆积方式相同,故选D。


 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 常温下同浓度的强酸、强碱等体积混合后由水电离出的c(H+) =10-7mol·L-l
B. 常温下pH =2的盐酸和pH =12的氨水等体积混合后c(C1-)+c(H+)=c(NH4+)+c(OH-)
C. 常温下0.1 mol.L-1的Na2A溶液的pH=10,则该溶液中由水电离的c(OH-)= 10 -10 mol.L-l
D. 常温下向10 mL0.1 mol.L-1的CH3 COOH溶液中滴加相同浓度的氨水,在滴加过程中,![]() 将减小
将减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为2L的密闭容器中进行如下反应:A(g)+2B(g)![]() 3C(g)+nD(g),开始时A为4mol,B为6mol;5min末时达到平衡并测得C的物质的量为3mol,用D表示的化学反应速率v(D)为0.2mol/(L·min)。计算
3C(g)+nD(g),开始时A为4mol,B为6mol;5min末时达到平衡并测得C的物质的量为3mol,用D表示的化学反应速率v(D)为0.2mol/(L·min)。计算
(1)5min末A的物质的量浓度为________mol/L。
(2)前5min内用B表示的化学反应速率v(B)为_____mol/(L·min)。
(3)化学方程式中n值为________。
(4)此反应在四种不同情况下的反应速率分别为:
①v(B)=6mol/(L·min) ②v(A)=5mol/(L·min)
③v(C)=4.5mol/(L·min) ④v(D)=8mol/(L·min)
其中反应速率最快的是_____(填编号)。
(5)相同条件下,密闭容器内开始时与平衡时的压强比为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于金属和金属材料的说法正确的是( )
A.铜具有良好的导电性,可以用来做导线
B.铜的化学性质不活泼,在潮湿空气中也不会生锈
C.废旧电池可以随处扔,不会对环境造成污染
D.铝合金门窗是用纯的金属铝材料制成的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随原子序数的递增,八种短周期元素(用字母X表示)原子半径的相对大小、最高正价或最低负价的变化如图所示,根据判断出的元素回答问题:
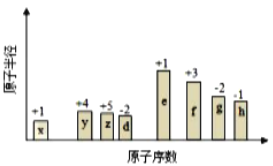
(1)f在元素周期表的位置是__________。
(2)比较d、e常见离子的半径的小(用化学式表示,下同)_______>__________;比较g、h的最高价氧化物对应的水化物的酸性强弱是:_______>__________。
(3)任选上述元素组成一种四原子共价化合物,写出其电子式____________________。
(4)上述元素可组成盐R:zx4f(gd4)2,向盛有10mL1mol·L-1R溶液的烧杯中滴加1mol·L-1NaOH溶液,沉淀物质的量随NaOH溶液体积变化示意图如图所示:
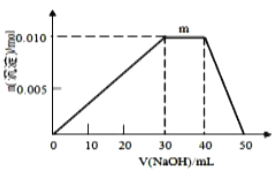
①R中存在的化学键有________________。
②写出m点反应的而离子方程式________________________________。
③若R溶液改加20mL1.2 mol·L-1Ba(OH)2溶液,充分反应后产生沉淀的物质的量为_______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烃A的质谱图中,质荷比最大的数值为42。碳氢两元素的质量比为6:1,其核磁共振氢谱有三个峰,峰的面积比为1:2:3。A与其他有机物之间的关系如下:

已知:CH2=CH2![]() HOCH2CH2OH,回答下列问题:
HOCH2CH2OH,回答下列问题:
(1)有机物B的分子式___________________________。
(2)高聚物F结构简式为___________________。
(3)写出C与新制的氢氧化铜反应的化学方程式___________________________。
(4)E在一定条件下可以相互反应生成一种六元环有机物H,H的结构简式________.。
(5)写出生成G的化学方程式_____________________________________________;
【答案】 )C3H8O2 ![]()
![]()
 n
n![]()
![]()
![]() +(n-1)H2O
+(n-1)H2O
【解析】试题分析:本题考查有机推断,涉及有机物分子式和结构简式的确定、有机物分子式和结构简式的书写、有机反应方程式的书写。A的质谱图中质荷比最大的数值为42,A的相对分子质量为42,烃A中n(C):n(H)=![]() :
: ![]() =1:2,A的实验式为CH2,A的分子式为(CH2)x,14x=42,解得x=3,A的分子式为C3H6,A的核磁共振氢谱有三个峰且峰的面积比为1:2:3,A的结构简式为CH2=CHCH3。A发生加聚反应生成的高聚物F的结构简式为
=1:2,A的实验式为CH2,A的分子式为(CH2)x,14x=42,解得x=3,A的分子式为C3H6,A的核磁共振氢谱有三个峰且峰的面积比为1:2:3,A的结构简式为CH2=CHCH3。A发生加聚反应生成的高聚物F的结构简式为![]() ;A→B发生题给已知的反应,B的结构简式为
;A→B发生题给已知的反应,B的结构简式为![]() ;B→C发生醇的催化氧化,C的结构简式为
;B→C发生醇的催化氧化,C的结构简式为![]() ;C与Cu(OH)2加热时,C中-CHO被氧化,酸化后得到的D的结构简式为
;C与Cu(OH)2加热时,C中-CHO被氧化,酸化后得到的D的结构简式为![]() ;D与H2发生加成反应生成E,E的结构简式为
;D与H2发生加成反应生成E,E的结构简式为![]() ;E中含羟基和羧基,E发生缩聚反应生成高聚物G,G的结构简式为
;E中含羟基和羧基,E发生缩聚反应生成高聚物G,G的结构简式为![]() 。
。
(1)B的结构简式为![]() ,B的分子式为C3H8O2。
,B的分子式为C3H8O2。
(2)高聚物F的结构简式为![]() 。
。
(3)C的结构简式为![]() ,C与新制Cu(OH)2反应的化学方程式为
,C与新制Cu(OH)2反应的化学方程式为![]() +2Cu(OH)2+NaOH
+2Cu(OH)2+NaOH![]()
![]() +Cu2O↓+3H2O。
+Cu2O↓+3H2O。
(4)E的结构简式为![]() ,2分子E通过酯化反应形成六元环有机物H,H的结构简式为
,2分子E通过酯化反应形成六元环有机物H,H的结构简式为 。
。
(5)G由E发生缩聚反应生成,生成G的化学方程式为n![]()
![]()
![]() +(n-1)H2O。
+(n-1)H2O。
【题型】推断题
【结束】
18
【题目】苯甲酸乙酯(C9H10O2)稍有水果气味,用于配制香水香精和人造精油,大量用于食品工业中,也可用作有机合成中间体、溶剂等。其制备方法为:
已知: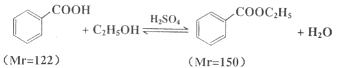
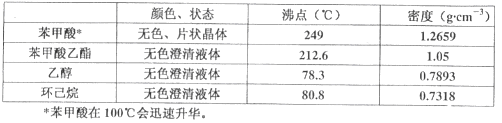

实验步骤如下:①在100 mL圆底烧瓶中加入12.20 g苯甲酸、25mL乙醇(过量)、20mL环己烷,以及4mL浓硫酸,混合均匀并加入沸石,按左上图所示装好仪器,控制温度在65~70℃加热回流2h。反应时环己烷-乙醇-水会形成“共沸物”(沸点62.6℃)蒸馏出来。再利用分水器不断分离除去反应生成的水,回流环己烷和乙醇。
②反应结束,打开旋塞放出分水器中液体后,关闭旋塞。继续加热,至分水器中收集到的液体不再明显增加,停止加热。
③将烧瓶内反应液倒入盛有适量水的烧杯中,分批加入Na2CO3至溶液呈中性。
④用分液漏斗分出有机层,水层用25mL乙醚萃取分液,然后合并有机层。加入氯化钙,对粗产品进行蒸馏(装置如图所示)。低温蒸出乙醚后继续升温,接收210~213℃的馏分。
⑤检验合格,测得产品体积为12.86mL.
(1)步骤①中使用分水器不断分离除去水的目的是_________________。
(2)步骤②中应控制馏分的温度在___________________。
A.65~70℃ B.78~80℃ C.85~90℃ D.215~220℃
(3)步骤③中若Na2CO3加入不足,在步骤④蒸馏时,蒸馏烧瓶中可见到白烟生成,产生该现象的原因是_____________。
(4)步骤④中分液操作叙述正确的是__________。
A.水溶液中加入乙醚,转移至分液漏斗中,塞上玻璃塞。将分液漏斗倒转用力振摇
B.振摇几次后需打开分液漏斗下口的玻璃塞放气
C.经几次振摇并放气后,手持分液漏斗静置待液体分层
D.分液操作时,分液漏斗中的下层液体由下口放出,然后再将上层液体由下口放出
蒸馏装置图中仪器A的名称是___________,在步骤④中加入氯化钙的作用是_________。
(5)该实验产品的产率为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+3B(g)![]() 2C(g)+2D(g),在四种不同情况下用不同物质表示的反应速率分别如下,其中反应速率最大的是( )
2C(g)+2D(g),在四种不同情况下用不同物质表示的反应速率分别如下,其中反应速率最大的是( )
A. v(C)=0.04mol/(L·s) B. v(B)=0.06mol/(L·s)
C. v(A)=0.03mol/(L·s) D. v(D)=0.01mol/(L·s)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com