
| A. | 牛油、纤维素和蛋白质都是天然高分子化合物 | |
| B. | 淀粉属于糖类 | |
| C. | 石油、植物油都只含有C、H两种元素 | |
| D. | 蛋白质遇硫酸铜溶液后产生的沉淀能重新溶于水 |
分析 A.牛油的成分为油脂,相对分子质量在10000以上的为高分子;
B.淀粉为多糖;
C.石油中含C、H、O、N、S、P元素等,而植物油含C、H、O元素;
D.硫酸铜为重金属盐,使蛋白质发生变性,变性为不可逆过程.
解答 解:A.牛油的成分为油脂,不属于高分子,而纤维素和蛋白质都是天然高分子化合物,故A错误;
B.淀粉为多糖,可水解生成葡萄糖,糖类物质含多羟基醛或酮结构,故B正确;
C.石油中含C、H、O、N、S、P元素等,而植物油含C、H、O元素,只有烃类物质只含C、H元素,故C错误;
D.硫酸铜为重金属盐,使蛋白质发生变性,则蛋白质遇硫酸铜溶液后产生的沉淀,不能重新溶于水,故D错误;
故选B.
点评 本题考查有机物的结构与性质,为高频考点,把握常见有机物的组成、官能团与性质的关系等为解答的关键,注重糖类、油脂、蛋白质基础知识的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子晶体中只有离子键没有共价键,分子晶体中肯定没有离子键 | |
| B. | SiO2晶体中每个硅原子与两个氧原子以共价键相结合 | |
| C. | 金刚石、SiC、NaF、NaCl、H2O、H2S晶体的熔点依次降低 | |
| D. | 晶体中分子间作用力越大,分子越稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
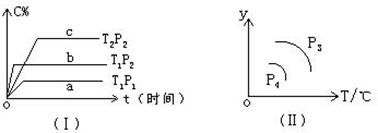
| A. | P3>P4,y轴表示A的转化率 | |
| B. | P3>P4,y轴表示B的质量分数 | |
| C. | P3>P4,y轴表示混合气体密度 | |
| D. | P3<P4,y轴表示混合气体的平均相对分子质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
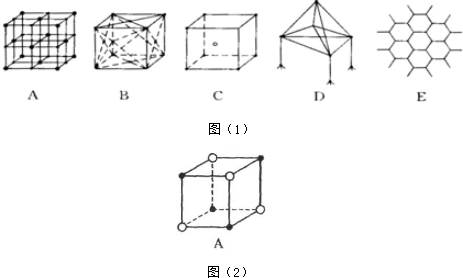
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
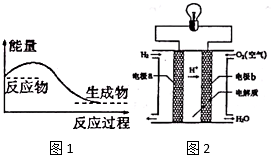 能盘是一个世界性的话题,如何充分利用能量、开发新能源,为人类服务是广大科技工作者不懈努力的目标.
能盘是一个世界性的话题,如何充分利用能量、开发新能源,为人类服务是广大科技工作者不懈努力的目标.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯的比例模型: | |
| B. | 甲基的电子式: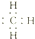 | |
| C. | 乙醇的分子式:C2H4O | |
| D. | 中子数为53、质子数为78的碘原子:${\;}_{53}^{153}$I |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na[Au(CN)2]可溶于水 | |
| B. | 化合物Na[Au(CN)2]中金元素的化合价为+2 | |
| C. | 金化学性质稳定,不与任何物质反应 | |
| D. | 在提炼过程中含金元素的物质始终作氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 80g CuO和Cu2S的混合物含有铜原子数一定为NA | |
| B. | 电解精炼铜时,当电路中转移NA个电子,阳极溶解32g铜 | |
| C. | 1mol铁与1molCl2充分反应,转移电子数为3NA | |
| D. | 向含有FeI2的溶液中通入适量氯气,当有1mol Fe2+被氧化时该反应转移电子的数目至少为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com