
| ||
| ||


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
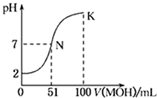 常温下,向l00mL 0.01mol/L HA的溶液中逐滴加入0.02mol/L MOH溶液,如图所示,曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法中正确的是( )
常温下,向l00mL 0.01mol/L HA的溶液中逐滴加入0.02mol/L MOH溶液,如图所示,曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法中正确的是( )| A、HA为一元强酸,MOH为一元强碱 |
| B、N点水的电离程度小于K点水的电离程度 |
| C、K点所示溶液中c(A-)>c(M+) |
| D、K点对应的溶液中,有c(MOH)+c(M+)=0.01mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 起始浓度 | 甲 | 乙 | 丙 |
| c(H2)/mol?L-1 | 0.010 | 0.020 | 0.020 |
| c(CO2)/mol?L-1 | 0.010 | 0.010 | 0.020 |
| A、平衡时,乙中CO2、H2的转化率相等 |
| B、平衡时,甲中和丙中H2转化率均是60% |
| C、平衡时,丙中c(CO2)是甲中的2倍,是0.008mol?L-1 |
| D、反应开始时,丙中的反应速率最快,甲中的反应速率最慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 品名 | 蔬菜苏打饼 |
| 配料 | 面粉、鲜鸡蛋、精炼食用植物油、白砂糖、奶油、食盐、脱水青菜、橙汁 |
| 保质期 | 十二个月 |
| 生产日期 | 2008年11月6日 |
| A、富含蛋白质的是鲜鸡蛋 |
| B、富含维生素的是脱水青菜和橙汁 |
| C、富含淀粉的是面粉和白砂糖 |
| D、富含油脂的是精炼食用植物油和奶油 |
查看答案和解析>>
科目:高中化学 来源: 题型:
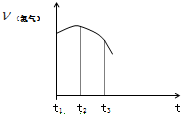 把除去氧化膜的镁条投入到盛有稀盐酸的试管中,产生氢气的速率变化情况如图所示图中t1~t2速率变化的主要原因是
把除去氧化膜的镁条投入到盛有稀盐酸的试管中,产生氢气的速率变化情况如图所示图中t1~t2速率变化的主要原因是查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com