
某反应的ΔH=+100 kJ·mol-1,下列有关该反应的叙述正确的是( )
A.正反应活化能小于100 kJ·mol-1
B.逆反应活化能一定小于100 kJ·mol-1
C.正反应活化能不小于100 kJ·mol-1
D.正反应活化能比逆反应活化能大100 kJ·mol-1
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
已知1 g氢气完全燃烧生成水蒸气时放出热量 121 kJ,且氧气中1 mol O===O键完全断裂时吸收热量496 kJ,水蒸气中1 mol H—O键形成时放出热量463 kJ,则氢气中1 mol H—H键断裂时吸收热量为( )
A.920 kJ B.557 kJ
C.436 kJ D.188 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
下列与金属腐蚀有关的说法,正确的是( )


A.图1中,铁钉易被腐蚀
B.图2中,滴加少量K3[Fe(CN)6]溶液,没有蓝色沉淀出现
C.图3中,燃气灶的中心部位容易生锈,主要是由于高温下铁发生化学腐蚀
D.图4中,用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁块相当于原电池的正极
查看答案和解析>>
科目:高中化学 来源: 题型:
如图装置中X和Y均为石墨电极,电解液为500 mL某蓝色溶液,电解一段时间,观察到X电极表面有红色的固态物质生成,Y电极有无色气体生成;溶液中原有溶质完全电解后,停止电解,取出X电极,洗涤、干燥、称量,电极增重1.6 g。下列有关说法中不正确的是( )
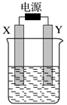
A.X电极是阴极
B.Y电极产生气体的体积为0.28 L
C.电解后溶液的pH=1
D.要使电解后溶液恢复到电解前的状态,需加入一定量的CuO或CuCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
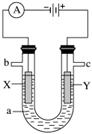
(1)若X、Y是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞,则:
①电解池中X极上的电极反应式是____________________________________________,
在X极附近观察到的现象是_________________________________________________。
②Y电极上的电极反应式是_______________________________________,
检验该电极反应产物的方法是____________________________________________。
(2)若用电解方法精炼粗铜,电解液a选用CuSO4溶液,则:
①X电极的材料是________________________________________,
电极反应式是__________________________________________。
②Y电极的材料是__________________________________________,
电极反应式是________________________________________________
(说明:杂质发生的电极反应不必写出)。
③当电路中有0.04 mol电子通过时,阴极增重_____________________________ g。
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室用4 mol SO2与2 mol O2在一定条件下进行下列反应:2SO2(g)+O2(g)??2SO3(g) ΔH=-196.64 kJ·mol-1,当放出314.624 kJ热量时,SO2的转化率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
件下反应获得。相关热化学方程式如下:
2Ca3(PO4)2(s)+10C(s)===6CaO(s)+P4(s)+10CO(g) ΔH1=+3 359.26 kJ·mol-1
CaO(s)+SiO2(s)===CaSiO3(s) ΔH2=-89.61 kJ·mol-1
2Ca3(PO4)2(s)+6SiO2(s)+10C(s)===6CaSiO3(s)+P4(s)+10CO(g) ΔH3
则ΔH3=________kJ·mol-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知某温度下CH3COOH的电离常数K=1.6×10-5。该温度下,向20 mL 0.01 mol·L-1 CH3COOH溶液中逐滴加入0.01 mol·L-1 KOH溶液,其pH变化曲线如图所示(忽略温度变化)。请回答下列有关问题:
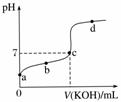
(1)a点溶液中c(H+)为________,pH约为________。
(2)a、b、c、d四点中水的电离程度最大的是________,滴定过程中宜选用__________作指示剂,滴定终点在________(填“c点以上”或“c点以下”)。
(3)若向20 mL稀氨水中逐滴加入等浓度的盐酸,则下列变化趋势正确的是________(填字母)。
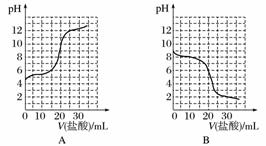

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com